本站讯(生命科学学院供稿)急性痛风性关节炎(Acute gouty arthritis, AGA)作为全球范围内最为常见的炎症性关节炎,通常是由于体内嘌呤代谢途径受损、尿酸排泄减少而导致大量尿酸单钠盐(Monosodium urate, MSU)结晶在关节和周围组织中过量沉积所导致。随着当今社会人口老龄化加剧和饮食结构改变,不良生活方式促使AGA发病率逐年上升且呈向低龄人群蔓延的趋势。AGA起病急骤,常在夜间发作。其临床特征包括趾端关节及周围软组织红肿,皮肤温度升高以及触痛等,被公认为最影响人类的急性痛症之一。目前临床药物疗效较差,且极易导致严重的胃肠损害。MSU在关节中沉积触发固有免疫激活。驻留巨噬细胞吞噬MSU,并释放一系列的细胞因子和趋化因子(例如IL-1β、TNF-α),进而募集中性粒细胞在关节处浸润,是AGA的典型病理学特征。然而,炎症关节中如何产生痛觉信号的机制仍不完全清楚。
天津大学生命科学学院史赛博士参与了该项研究。其所在团队通过建立AGA小鼠模型和高通量测序技术发现,炎症组织中CXC趋化因子家族成员CXCL5表达显著上调。通过神经元逆行标记技术结合免疫荧光实验发现,其受体CXCR2在支配关节神经元中存在大量表达。细胞钙成像和膜片钳实验发现CXCL5可作用于CXCR2,引发钙内流,造成神经元去极化,导致模型动物出现关节疼痛。分子对接与计算机模拟发现,CXCR2受体活化后其下游Gβ蛋白与疼痛相关离子通道TRPA1产生耦合,诱导TRPA1通道开放,是神经元活化的关键机制。同时该团队还发现,在痛风条件下,支配炎症关节的外周感觉神经元激活后通过轴突反向分泌大量CGRP和SP神经肽物质,作用于它们的受体,引发血管舒张和血浆外渗,使得CXCL5募集大量中性粒细胞浸润,导致模型小鼠局部组织出现神经源性炎症。浸润的中性粒细胞释放ROS和炎症介质,进一步加剧痛风疼痛和关节炎症。上述结果表明,特异性靶向关节支配感觉神经元中的CXCR2可能是未来痛风性关节炎治疗的一种潜在策略。
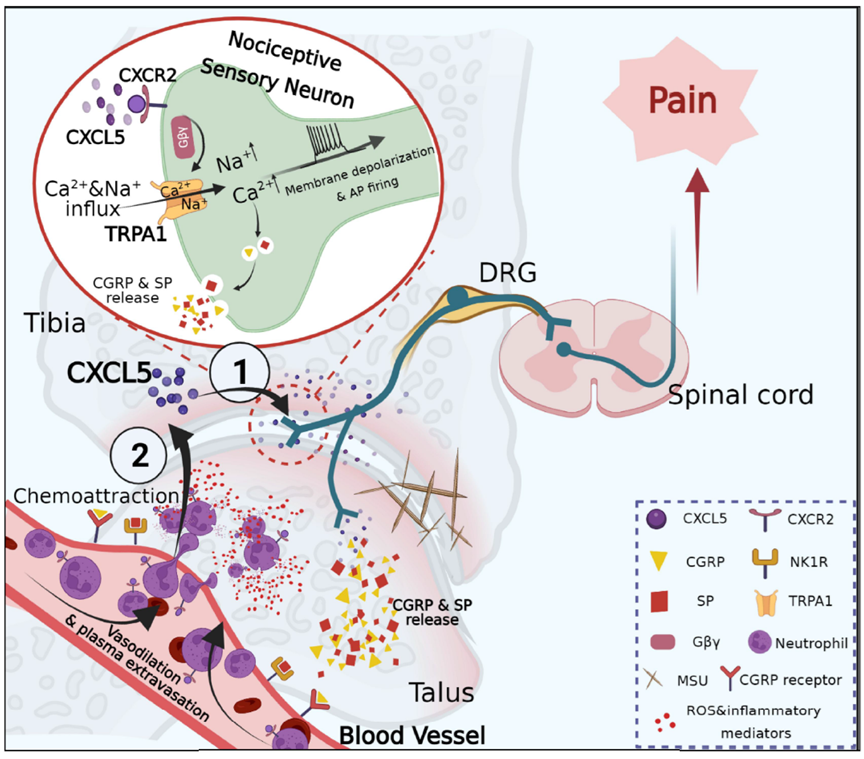
上述研究成果由天津大学生命科学学院与浙江中医药大学、河北工业大学、河北医科大学合作以题为“CXCL5 activates CXCR2 in nociceptive sensory neurons to drive joint pain and inflammation in experimental gouty arthritis”的论文发表在《Nature Communications》上。天津大学生命科学学院史赛博士为论文的共同第一作者。
原文链接:
https://www.nature.com/articles/s41467-024-47640-7#Sec45
(编辑 赵晖 常可盈)

