本站讯 近日,药学院张雁教授团队联合药学院尉迟之光、伊利诺伊大学香槟分校Huimin Zhao教授团队,在体外构建了URC1的活性,证实了其底物为尿嘧啶核苷三磷酸(UTP),并首次解析了该家族酶的完整蛋白结构(图3A),提出URC1活性中心的一个关键赖氨酸参与催化UTP水解并与其形成共价键,利用UTP水解释放的能量,使底物的嘧啶环与酶Zn2+离子活性中心精准配位,再通过类似Zn2+蛋白酶的机制,在尿嘧啶C6和C4上连续两次亲核攻击催化嘧啶水解开环的新颖酶催化机制(图2B)。该合作团队进一步通过定点突变结合偶联酶颜色反应,中间产物的质谱检测等手段证实催化机理。论文近日在ACS Catalysis线上发表。
嘧啶作为核酸重要组成,是自然环境中含量丰富的有机化合物,因而被微生物用作氮、碳以及能量源。科学家研究微生物的嘧啶降解通路已经有半个多世纪的历史。
因为嘧啶具有芳香性,其开环的键断裂反应较为困难。微生物利用了多种方法来解决这一问题,已知的嘧啶降解通路有三条:第一,嘧啶的还原降解途径通过二氢嘧啶脱氢酶催化尿嘧啶还原反应来降低嘧啶环的芳香性;第二,嘧啶的氧化降解途径通过尿嘧啶氧化酶催化尿嘧啶氧化来降低嘧啶环的芳香性;第三,通过含黄素过氧化氢的酶来形成中间物催化开环反应(图1)。
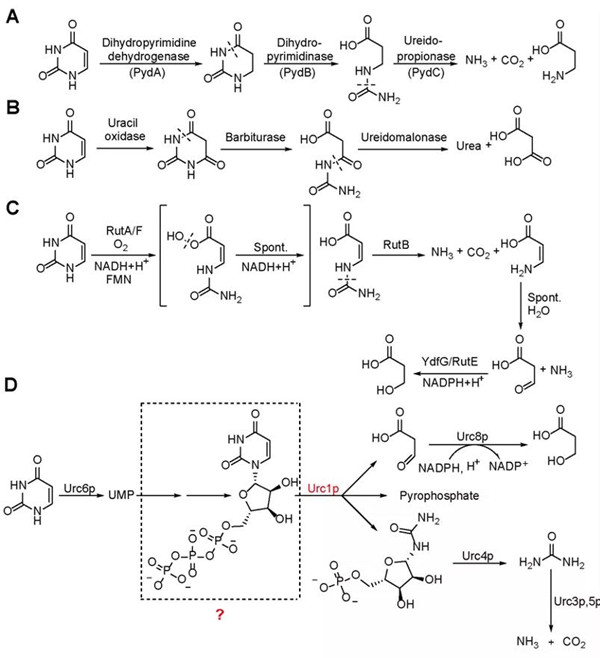
图1.已知的嘧啶降解三条途径与本次探明的第四条嘧啶降解途径。A)还原降解途径;B)氧化降解途径;C) RUT降解途径;D) URC途径。红色标记为关键酶催化嘧啶环开环的URC1酶
瑞典隆德大学法国科学家Jure Piskur在2008年提出在原核和真核生物中都存在第四条嘧啶降解途径,这一途径依赖URC1酶催化嘧啶的开环,并认为底物是尿嘧啶核苷单磷酸(UMP),但未能实现该关键酶的体外活性检测,催化机理不明。2014年Piskur教授不幸去世,该项重要工作中断。
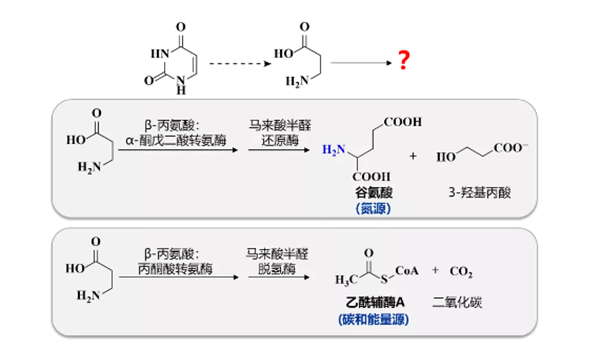
图2.最近发现的两条微生物嘧啶还原降解通路的延伸
药学院张雁教授团队长期研究微生物的初级代谢,包括氨基酸、糖和核酸的初级代谢。此前张雁教授团队发现了两条嘧啶还原降解通路的延伸:不同微生物利用这两条延伸通路继续降解嘧啶还原通路的“终产物”β-丙氨酸,分别获得氮源以及碳和能量源(图2)。
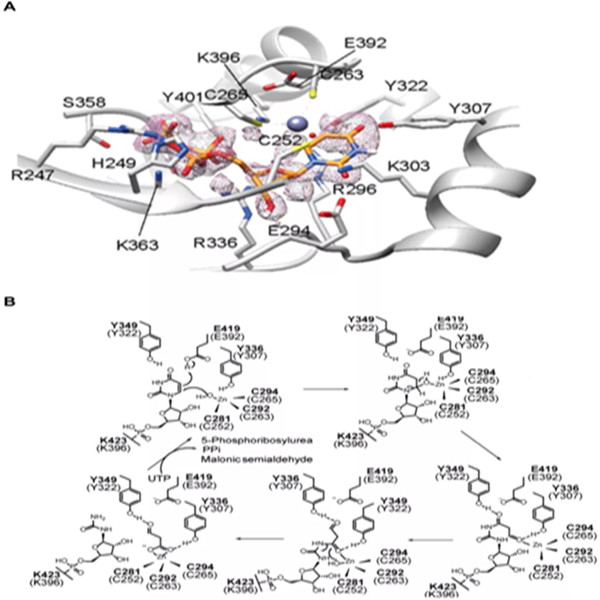
图3. URC1酶与底物复合物晶体结构以及催化机理。A)酶与底物复合物晶体结构;B)可能的催化机理
药学院张雁教授课题组硕士生张海彬以及新加坡A*Star Huimin Zhao课题组的Yifeng Wei博士为论文的共同第一作者。

(编辑 李丹 齐鲁杰)

