本站讯(通讯员 武璇)天然蜘蛛丝具有优异的机械性能。它们通常由多种蛛丝蛋白构成,包括主要和次要成分蛋白。由于蜘蛛的独居和互食性,大规模高密度饲养无法实现,因此人工纺丝是大量获得高强度丝纤维的一种重要手段,而蛛丝蛋白结构与功能的研究,是生产丝纤维的基础。虽然各种蛛丝主要成分蛋白的结构和功能已经得到了广泛的研究,但对蛛丝的次要成分在蛛丝蛋白自组装和纤维形成过程中的分子机理却知之甚少,这严重妨碍了高性能人造蛛丝蛋白的设计与制备。

2021年9月21日,天津大学生命科学学院林志教授团队在美国科学院院刊PNAS上发表了题为Critical role of minor eggcase silk component in promoting spidroin chain alignment and strong fiber formation的研究论文。这项研究通过核磁共振(NMR)并结合材料学技术,开展了对蜘蛛卵鞘丝次要成份蛋白TuSp2的结构与成丝机理研究,并发现由主要与次要成份蛋白共同纺出的人造丝的强度比天然卵鞘丝更优异,为理性设计高机械性能丝蛋白材料提供了新的方向。
本文要点:
1)该研究首先发现蜘蛛卵鞘丝次要成份蛋白TuSp2不仅能加速主要成分蛋白TuSp1的自组装,还能在机械剪切力作用下显著促进纤维中丝蛋白的有序排列,这表明TuSp2在卵鞘丝形成中的具有关键的作用。
2)TuSp2由多个重复结构域(RP)组成,但并不具有典型的丝蛋白末端非重复结构域。为了探究它在成丝中的作用机制,作者通过多维核磁共振图谱解析了TuSp2重复结构域的溶液结构。结构研究表明,TuSp2-RP在溶液中主要通过疏水作用形成二聚体,该二聚体结构拥有两个独特的带负电荷表面区块,进而可以募集表面带正电荷的TuSp1重复结构域。同时,它也能结合TuSp1末端结构域。对接结构表明,一分子TuSp2-RP二聚体可以结合至少三分子TuSp1重复结构域。基于以上研究,作者提出了TuSp1:TuSp2的胶束模型。该模型解释了为何由TuSp1:TuSp2复合物形成的丝纤维比由单独TuSp1形成的具有更高双折射效应(图1)。
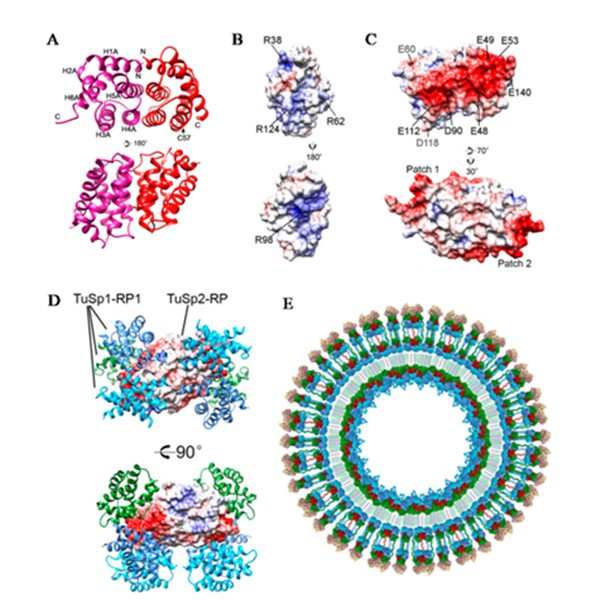
图1. TuSp2-RP与TuSp1-RP相互作用的结构基础和胶束模型
3)作者进一步基于结构机理研究设计了含TuSp1和TuSp2的微型丝蛋白,以探究次要成分对丝纤维机械性能的影响。研究发现由TuSp1和TuSp2微型丝蛋白复合物纺成的人造蛛丝纤维,比由单独的TuSp1形成的纤维具更少的表面与内部结构缺陷,进而具有更好的物理性能。在最优的TuSp1和TuSp2比例下,其强度和杨氏模量甚至超越天然卵鞘丝(图2)。
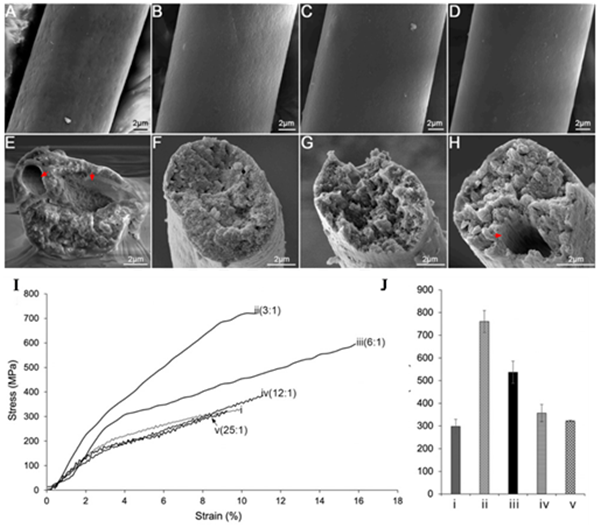
图2.重组卵鞘丝纤维的SEM表征及机械性能
综上所述,这项工作明确了TuSp2在卵鞘丝形成中的关键作用,揭示了TuSp2促进卵鞘丝蛋白自组装和分子有序排列的结构机理;此外,该研究中开发的共纺策略也为生产具有可预测物理性能的其它类型人造蛛丝纤维提供了新启示。
本论文第一作者是天津大学生命科学学院博士生范天天;秦瑞奇、张燕、王景霞和樊劲松为共同第一作者;通讯作者为天津大学生命科学学院林志教授。合作单位为新加坡国立大学杨代文教授团队和宁夏医科大学黄卫东教授团队。南开大学苏循成教授团队为此工作提供了大力支持。本项研究得到了天津大学双一流经费支持。
原文链接:https://doi.org/10.1073/pnas.2100496118
(编辑 张华 王昊恩)

