本站讯(课题组 供稿)TMEM16A是一种钙离子激活的氯离子通道,广泛表达于各种细胞。TMEM16A在多种生理功能中发挥重要作用,包括神经信号的传递、平滑肌收缩以及上皮细胞分泌的调节等。此外,TMEM16A已被证明在多种癌细胞中高表达,TMEM16A的上调被认为与乳腺癌、胰腺癌或胃癌患者的总生存率降低有关。并且,TMEM16A抑制剂对多种癌症有明显的治疗作用,包括肺癌、结直肠癌、口腔鳞状细胞癌和乳腺癌。重要的是,TMEM16A的抑制剂还被认为具有抗高血压,镇痛以及治疗分泌性腹泻的潜力。TMEM16A已经被广泛认为是治疗上述几种疾病的药物靶点。2021-2022年,团队的史赛博士与博士研究生马标作为第一作者,安海龙教授作为通讯作者在Journal of Biological Chemistry发文揭示了TMEM16A脱敏状态下一处位于细胞外前庭区域的非选择性抑制剂结合口袋(JBC.2021.101016)。团队基于药物再利用策略,利用虚拟筛选和电生理实验等手段发现抗哮喘药物——扎鲁司特可以通过抑制TMEM16A而抑制肺腺癌肿瘤的生长(JBC.2022.101731)。上述研究为基于TMEM16A结构进行药物设计提供了关键的靶点信息。值得关注的是,所有报道的TMEM16A结构要么是关闭的,要么是脱敏的,抑制剂分子对通道开放态的直接抑制缺乏可靠的结构基础。因此,揭示TMEM16A在开放状态下的药物结合口袋对于理解蛋白质与配体的相互作用和促进合理的药物设计非常重要。
近日,天津大学叶升教授课题组与河北工业大学安海龙教授课题组合作在Journal of Biological Chemistry发表题为“Identification of a druggable pocket of the calcium-activated chloride channel TMEM16A in its open state”的研究论文。该研究通过分子动力学模拟和电生理实验揭示了TMEM16A通道的开放态构型,并基于该结构鉴定了一处重要的药物结合口袋。

首先,团队采用加速分子动力学模拟和分段模建技术重构了TMEM16A开放态结构(图1A)。与脱敏态结构相比,跨膜螺旋TM3和TM4在开放态结构中有明显的构象重排。特别是TM4上段位移超过5Å(图1B)。孔道分析显示,TMEM16A开放态的孔道形似漏斗(图1C),除氯离子结合位点(K645)外,孔道其他区域半径超过2Å(氯离子半径为1.8Å)。这些数据表明,重构的TMEM16A结构处于开放状态。
随后,团队揭示了TMEM16A开放态结构中一处经典的抑制剂结合口袋。比较TMEM16A脱敏状态和开放状态,TM3和TM4的重排显著改变了细胞外前庭的构型,形成一个空间为1488Å3的抑制剂结合口袋(图1D)。为了验证结合口袋的合理性,团队构建了中药单体和衍生物虚拟库,基于该口袋结构进行了虚拟筛选(图1E)。团队成功筛选到一种鬼臼毒素衍生物,依托泊苷(Etoposide),能够以浓度依赖的方式抑制TMEM16A电流,其IC50为13.6±1.3μM。
进一步,团队确证了TMEM16A抑制剂依托泊苷的结合位点。团队通过分子模拟、定点突变以及电生理实验发现,R535A/K603A/R621A的突变对依托泊苷的影响均弱于T518A/N546A/E633A,说明依托泊苷更可能结合于开放状态下的药物结合口袋(图1F)。同时,量化计算和构象自由能分析表明依托泊苷的d/e/f环是结合TMEM16A的关键位点,a/b/c/d环的侧向插入进一步稳定了依托泊苷的结合构象(图1G)。
最后,团队测试了依托泊苷靶向TMEM16A抑制前列腺癌的药理活性。电生理实验表明Etoposide (100μM)能够显著降低前列腺癌PC-3细胞的TMEM16A电流。50μM和100μM的依托泊苷对PC-3细胞集落形成的抑制率分别达到55 %和70 %(图1H)。然而,当使用shRNA敲低PC-3细胞内源性TMEM16A的表达时,依托泊苷对PC-3的抑制作用减弱(图1I-J)。上述结果表明依托泊苷可以靶向TMEM16A抑制前列腺癌细胞活力,可以作为一种抗前列腺癌候选药物。
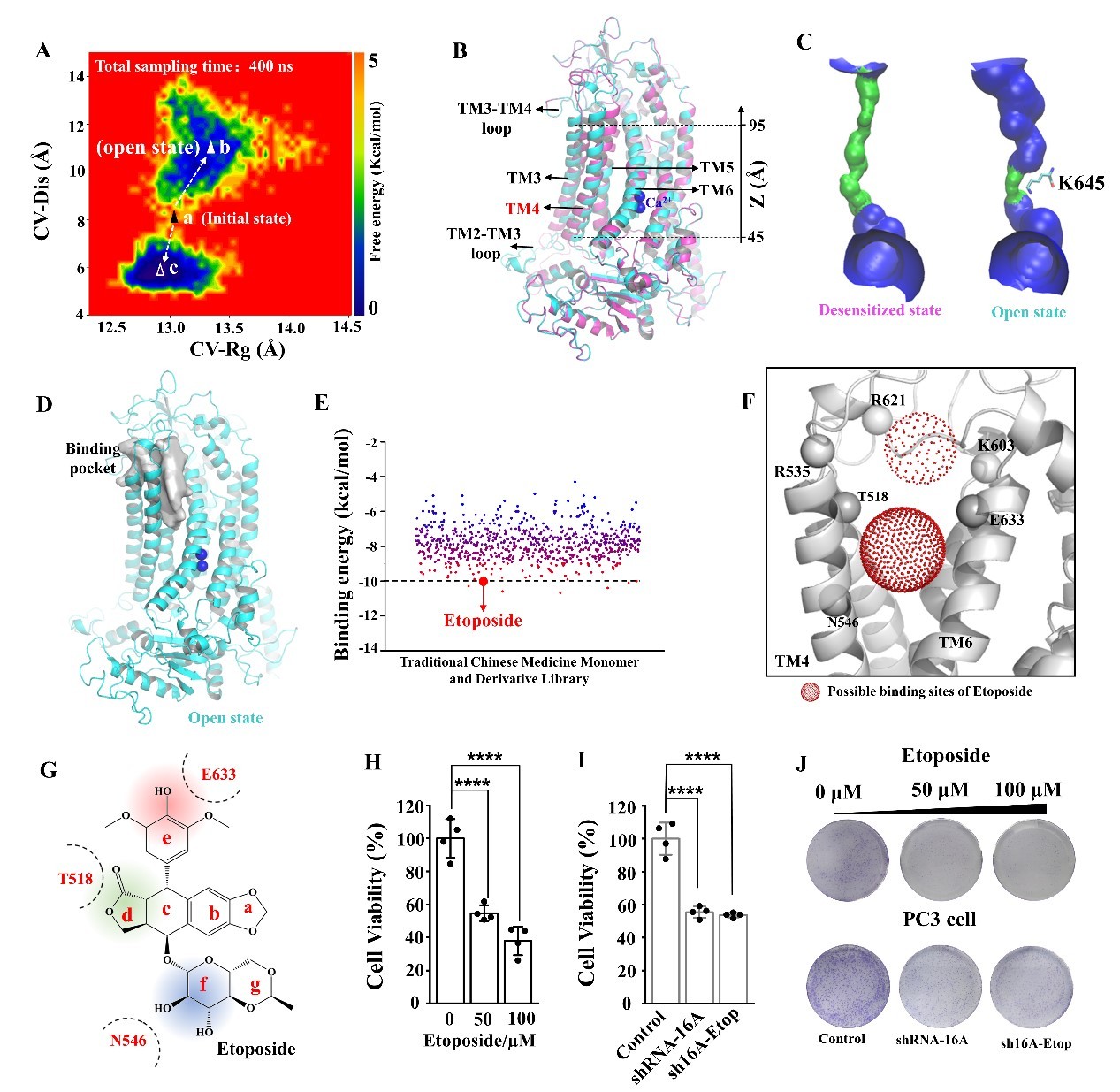
图1.(A)增强采样的构象空间;(B-C)TMEM16A开放态与关闭态结构及其孔道;(D)TMEM16A开放态下的抑制剂结合口袋;(E)虚拟筛选;(F)依托泊苷的结合位点;(G)依托泊苷与TMEM16A结合模式;(H-J)依托泊苷抑制前列腺癌细胞活性实验。
总之,该研究提供了在原子水平上对TMEM16A开放状态的进一步理解,并确定了一处重要的药物结合口袋,为设计新型抑制剂提供了可靠的结构基础,将极大地促进TMEM16A相关疾病的药物开发进程。
天津大学生命科学学院叶升教授,河北工业大学生命科学与健康工程学院安海龙教授,河北大学生命科学学院郭帅博士为本文的共同通讯作者。天津大学生命科学学院叶升教授课题组博士后史赛,河北工业大学博士研究生马标,天津大学药学院博士研究生纪秋爽为本文的共同第一作者。史赛博士负责计算机辅助药物设计与分子模拟工作,博士生马标、纪秋爽以及郭帅博士负责电生理与细胞生物学和分子生物学实验。该研究工作获得科技部、国家自然科学基金、中国博士后科学基金等经费资助。
原文链接:https://doi.org/10.1016/j.jbc.2023.104780
(编辑 赵晖 王敬蕾)

