本站讯(天津大学生命科学学院供稿)阿尔兹海默病(AD)是一种常见于老年人群的难治性神经退行性疾病,其病因复杂多样。铁作为大脑正常生理生化过程中最丰富的必需微量元素,其代谢稳态失调在AD发生发展中起着至关重要的作用。脑内过量的氧化还原活性铁离子,会转移到线粒体催化芬顿反应,产生大量活性氧自由基,导致脂质过氧化,最终造成铁死亡,加剧神经退化和认知衰退。
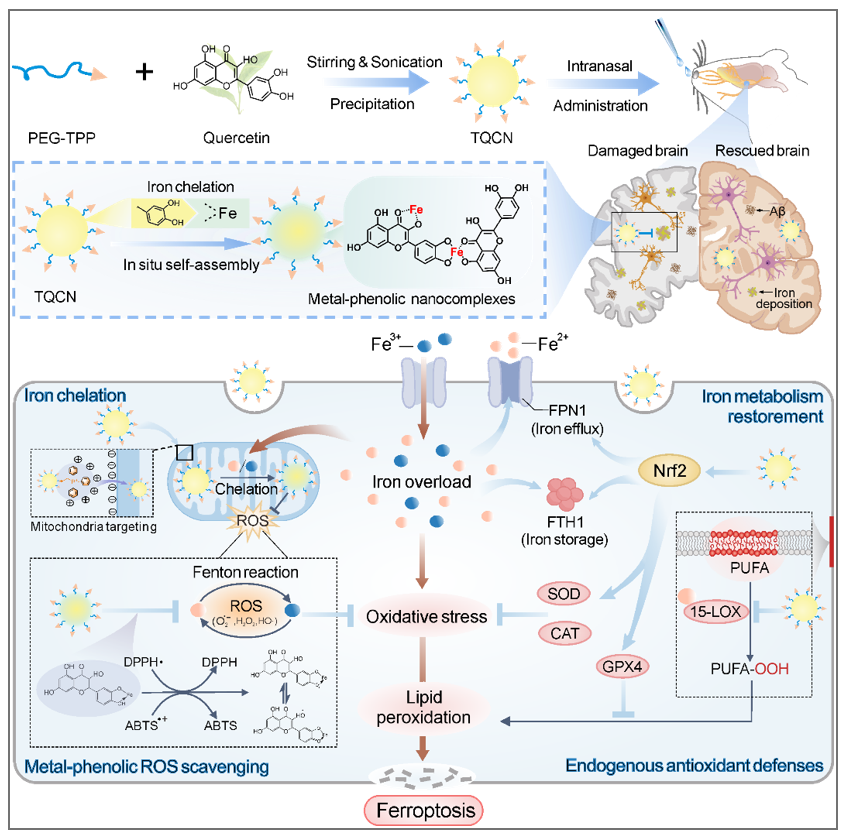
近日,天津大学生命科学学院常津教授及天津医科大学总医院窦妍副研究员团队共同在《ACS Nano》(一区,IF=17.1)上发表了题为“In Situ Self-Assembled Phytopolyphenol-Coordinated Intelligent Nanotherapeutics for Multipronged Management of Ferroptosis-Driven Alzheimer’s Disease”的研究论文,首次开发了一种线粒体靶向的槲皮素智能纳米药物TQCN,通过植物多酚介导的自发配位作用原位自组装形成金属-酚纳米复合物,同时触发多种抗铁死亡途径,实现对脑内铁沉积的多尺度调控,最终有效改善AD小鼠认知障碍,显著抑制大脑铁死亡驱动的AD进展。

该纳米药物,一方面,通过植物多酚结构上的金属结合位点,与铁螯合并原位自组装形成金属-酚纳米复合物,从而最大限度地发挥外源性抗氧化作用。另一方面,通过激活Nrf2信号通路,恢复铁代谢稳态,重塑内源性抗氧化防御系统。凭借鼻腔给药介导的脑内有效递送以及线粒体精准靶向,TQCN可显著改善APP/PS1小鼠脑内铁沉积及其诱导的神经元损伤和Aβ积累,抑制氧化应激、脂质过氧化以及线粒体损伤,最终有效缓解大脑铁死亡驱动的AD进展。这项工作拓展了天然智能纳米药物靶向铁死亡抑制AD发病机制的应用前景,并为铁死亡介导的相关神经退行性疾病治疗提供了新策略和新思路。
天津大学生命科学学院常津教授和天津医科大学总医院窦妍副研究员为本文的共同通讯作者。天津大学生命科学学院硕士生刘逸宁和博士生赵冬菊为本文的共同第一作者。天津大学杨帆、陈紫瑶、于潇濛、谢佶尧,天津医科大学叶才华、陈奕涵也为该研究做出了贡献。天津大学生命科学学院为本论文第一完成单位,该研究获得国家自然科学基金、天津市自然科学基金、天津市医学重点学科(专科)建设项目等经费资助。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c09286
(编辑 张华 王淑敏)

