本站讯(生命科学学院供稿)免疫抑制性的肿瘤微环境是造成肿瘤免疫治疗的主要障碍之一,尤其是肿瘤微环境中的肿瘤相关巨噬细胞往往以免疫抑制性M2表型为主,促进肿瘤生长与转移。尽管当前调控肿瘤相关巨噬细胞的治疗策略(如细胞因子和RNA干扰疗法)展现出一定前景,但由于需要反复注射,效果可持续性较差,疗效有限。因此,开发一种高效、持续的联合治疗策略尤为关键。
近日,天津大学生命科学学院王汉杰研究团队在《Biomaterials》(一区,IF=12.8)上发表了题为“In situ production and precise release of bioactive GM-CSF and siRNA by engineered bacteria for macrophage reprogramming in cancer immunotherapy”的研究论文。研究团队设计了一种细菌治疗平台,通过两株工程菌的协同作用,持续高效地在体内生产和释放生物活性药物,用于重编程肿瘤相关巨噬细胞以增强抗肿瘤免疫效应。
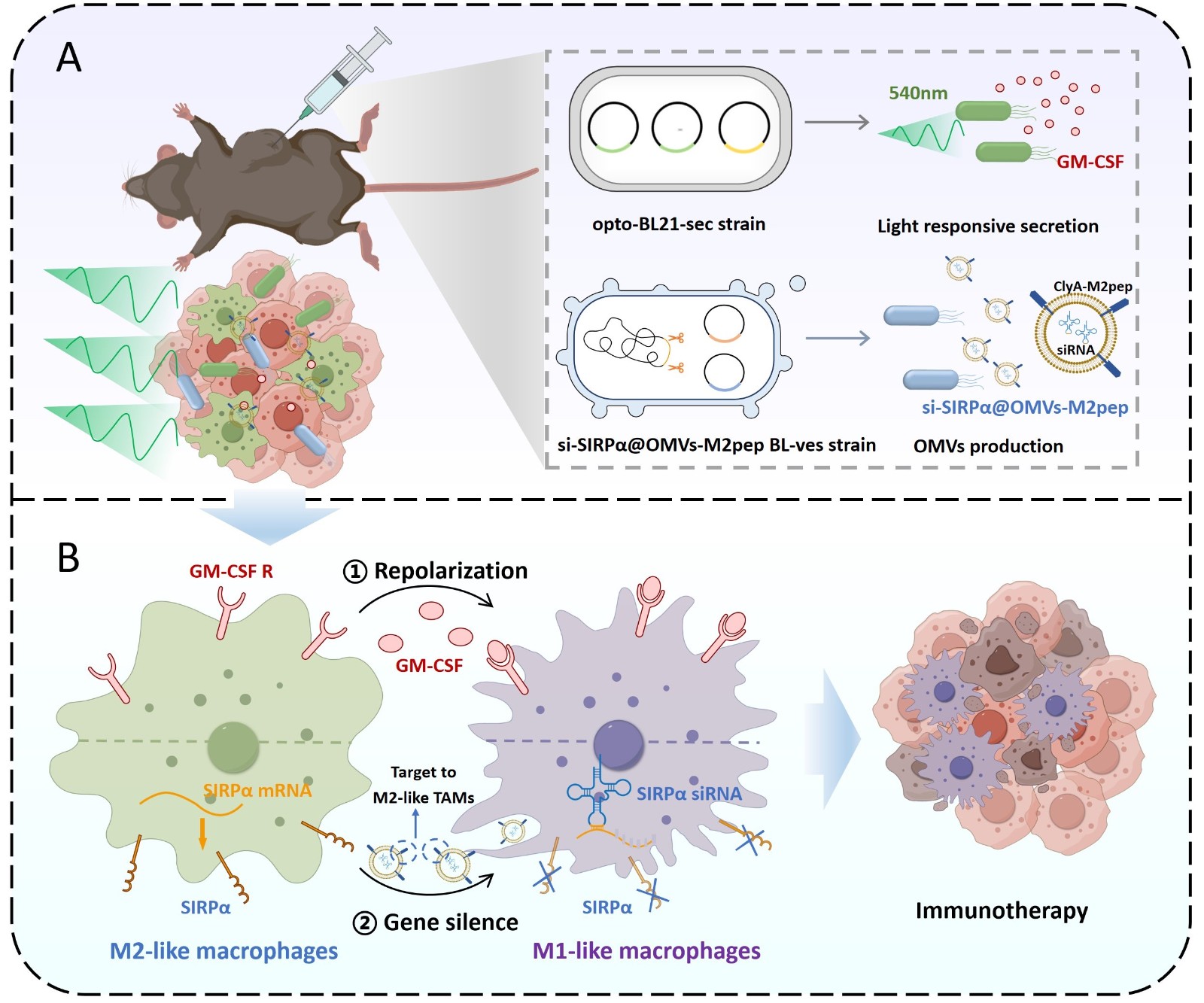
研究团队首先设计了一株工程菌(opto-BL21-sec),该菌株通过引入溶血素分泌系统,并结合光遗传学调控策略,实现了在绿光刺激下持续分泌粒细胞-巨噬细胞集落刺激因子(GM-CSF),促进免疫抑制性M2型巨噬细胞向免疫活性M1型巨噬细胞的复极化。
其次,团队设计了另一株工程菌(si-SIRPα@OMVs-M2pep BL-ves),可高效生产携带信号调控蛋白α(SIRPα)小干扰RNA(siRNA)的外膜囊泡(OMVs),降低肿瘤相关巨噬细胞表面SIRPα的表达,从而阻断CD47-SIRPα免疫逃逸通路,增强免疫效应。
通过这两株工程菌的协同作用,该细菌原位治疗平台能够实现M2型巨噬细胞的持续重编程,并有效抑制肿瘤生长。该研究不仅扩展了工程菌作为在体“药物工厂”的潜力,也为重编程巨噬细胞以增强肿瘤免疫治疗提供了新的思路。
天津大学生命科学学院王雅欣,张新宇,徐州医科大学樊亚丽为本文的共同第一作者。天津大学生命科学学院王汉杰、康君,徐州医科大学张英英为本文的共同通讯作者,天津大学生命科学学院为本论文第一完成单位。该研究获得国家重点研发计划“合成生物学”专项、国家自然科学基金委员会优秀青年科学基金、天津市杰青基金、京津冀基础研究合作专项项目等项目的资助。
原文链接:https://doi.org/10.1016/j.biomaterials.2024.123037
(编辑 赵晖 王淑敏)

