本站讯(生命科学学院供稿)翻译后修饰(Post-Translational Modification, PTM)能够影响蛋白质的结构、功能、细胞定位和稳定性,对于生命活动至关重要。其中,Asn脱酰氨基化和Asp异构化能够在蛋白质中自发进行,最终形成独特的β-链接氨基酸,即异天冬氨酸(L-isoaspartate,isoAsp)。如图1所示。Asn/Asp自发形成的isoAsp是一种具有普遍性的蛋白质PTM,与许多疾病相关,但由于形成过程时间长(半期以月和年计算)、位点多,isoAsp相关生物学研究十分困难。同时,作为一种β-氨基酸,isoAsp在生物医药领域有重要应用价值。

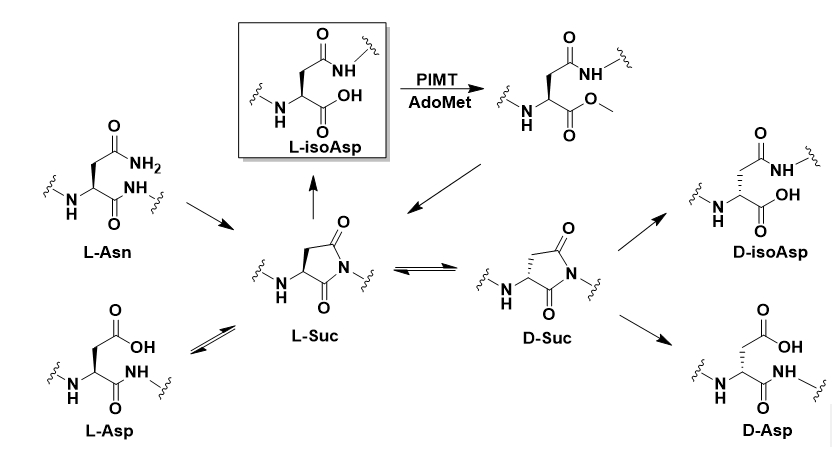
图1.蛋白质中Asn脱酰氨基化和Asp脱水异构化示意图,以及PIMT对L-isoAsp的修复原理。
近期,轩维民课题组受PIMT对isoAsp修复过程的启发,设计侧链羧基酯化的Asp衍生物,作为非天然氨基酸(noncanonical amino acid, ncAA),利用密码子扩展技术(Genetic Code Expansion,GCE)将其引入蛋白质;侧链酯基将加速C端氨基酸α-N的分子内亲核取代反应,促进中间体Suc形成;之后Suc可自发水解,生成isoAsp。
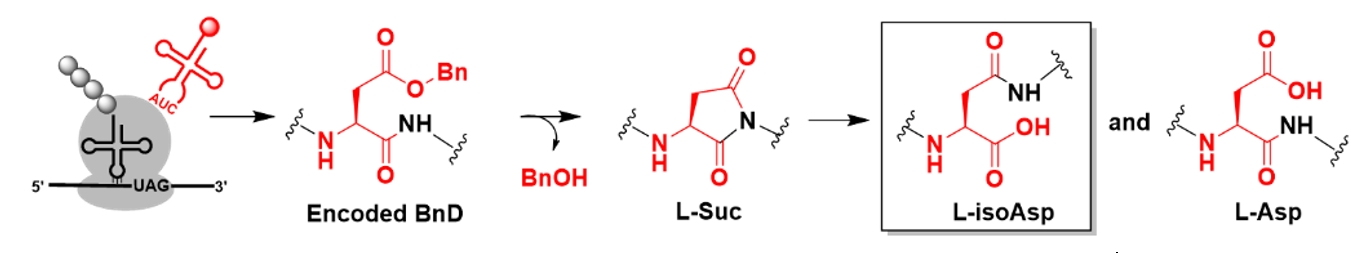
图2.位点选择性引入isoAsp的原理示意图。
实验中,作者通过基因编码BnD在蛋白质(如钙调蛋白、超氧化物歧化酶1等)特定位点构建isoAsp修饰,验证了Asn异构对蛋白质结构的损伤;分析表明,本方法可将Asn异构化速率提升1000倍,是构建isoAsp的有效方法。此外,isoAsp赋予的独特拓扑结构和蛋白酶耐受性,在生物药物研发中具有重要的应用前景。
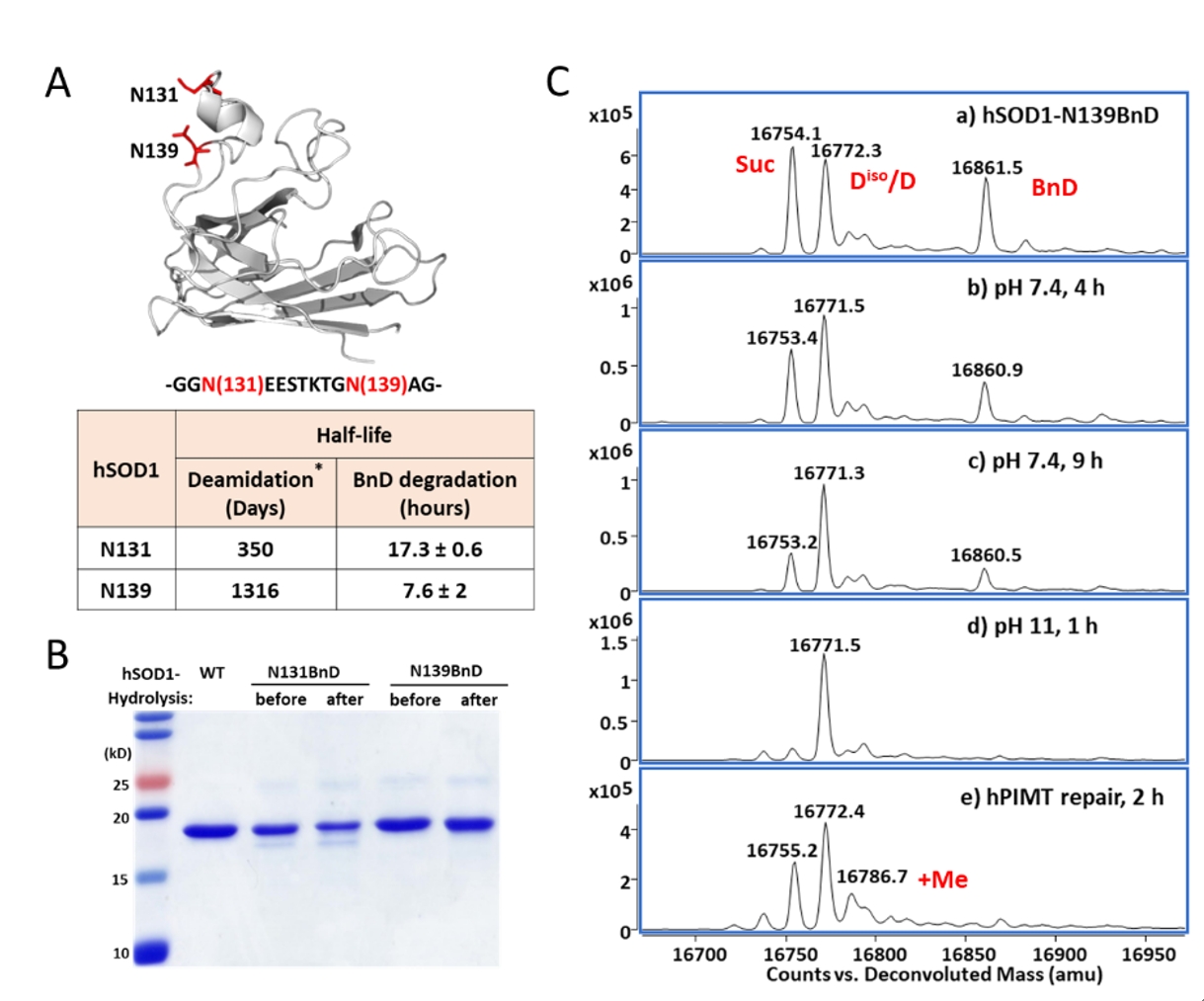
图3. 通过编码BnD,显著加速蛋白中特定位点isoAsp的形成。
该工作近日发表于Angewandte Chemie International Edition,文章的第一作者为吴启凡博士(现就职于燕山大学)和博士生杨晓晨,轩维民教授为该工作的通讯作者。南开大学苏循成教授、大连理工大学秦洪强教授在实验过程中对本项目做出了重要贡献。该工作得到了叶升教授及团队的大力支持。该研究得到了国家重点研发计划以及国家自然科学基金的经费资助。
(编辑 刘延俊 郭新婷)

