本站讯(通讯员 徐冰红)乳酸、丙酮酸、酮体、乙酰乙酸和β-羟基丁酸等单羧酸是细胞重要的分解代谢产物,同时它们作为底物参与到其他生物代谢途径中。细胞为了能够正常的生存和生长,需要对这些代谢产物进行精确地调控。人体的细胞中存在着多种转运单羧酸的蛋白,其中最主要的是单羧酸转运体(Monocarboxylate transporter,MCT),属于溶质运载蛋白家族(Solute carrier family,SLC family)。部分MCTs定位在细胞膜上受到单次跨膜的伴侣蛋白Basigin或者embigin的调控。大量的研究表明MCTs在肿瘤细胞的生长和其他疾病中发挥着重要的作用,它们不仅被当作肿瘤细胞的生物标记而且被当作治疗肿瘤的药物靶点。然而至今为止,人们对单羧酸转运体的定位、结构与功能方面的信息了解很少。
近日,天津大学叶升课题组与天津大学严汉池课题组、深圳先进研究院张小康课题组、清华大学陈立功课题组、西湖大学裴端卿课题组合作,在Cell Reports杂志发表题为Embigin facilitates monocarboxylate transporter 1 localization to the plasma membrane and transition to a decoupling state的研究论文。通过高分辨单颗粒冷冻电镜,细胞成像技术,体外亲和纯化技术以及表面等离子体共振等研究手段,揭示了伴侣蛋白embigin调控人源单羧酸转运体1(MCT1)定位在细胞膜上和改变MCT1协同转运的分子机制。
叶升课题组在2020年通过活细胞成像技术,发现人源单羧酸转运体2(MCT2)在转运丙酮酸时存在协同性(希尔系数n = 1.6)。MCT2的协同转运机制对细胞具有重要的生理意义。当细胞内代谢产生的单羧酸浓度急剧升高时,细胞通过使单羧酸转运体活性达到最大且迅速地将代谢产物转运出细胞,以维持细胞内正常的代谢。单羧酸不仅是代谢产物,还参与到细胞的生物合成代谢中。细胞需要维持一定浓度的单羧酸用于合成代谢。因此,当细胞内的这类代谢产物低于生理浓度时,细胞通过使单羧酸转运体失活使这些代谢产物不被转运出细胞。
为了解释MCT2存在协同转运的分子机制,他们解析了第一个人源未结合底物状态的MCT2的高分辨结构。MCT2的二聚化形式与所有已知结构的SLC家族的转运体结构都不相同。MCT2二聚体的一个亚基的氮端结构域和碳端结构域分别与另一个亚基的两个结构域存在相互作用并且部分区域发生穿插。MCT2亚基之间通过大的疏水交界面形成二聚体。靠近细胞质一侧,MCT2二聚体的一个亚基的TM1保守区域与另一个亚基的TM4-TM5连接的保守区域形成氢键网络。当这些氢键网络被破坏后,MCT2转运丙酮酸时不存在协同性。结果说明该处氢键网络的形成是MCT2存在转运协同性的结构基础。
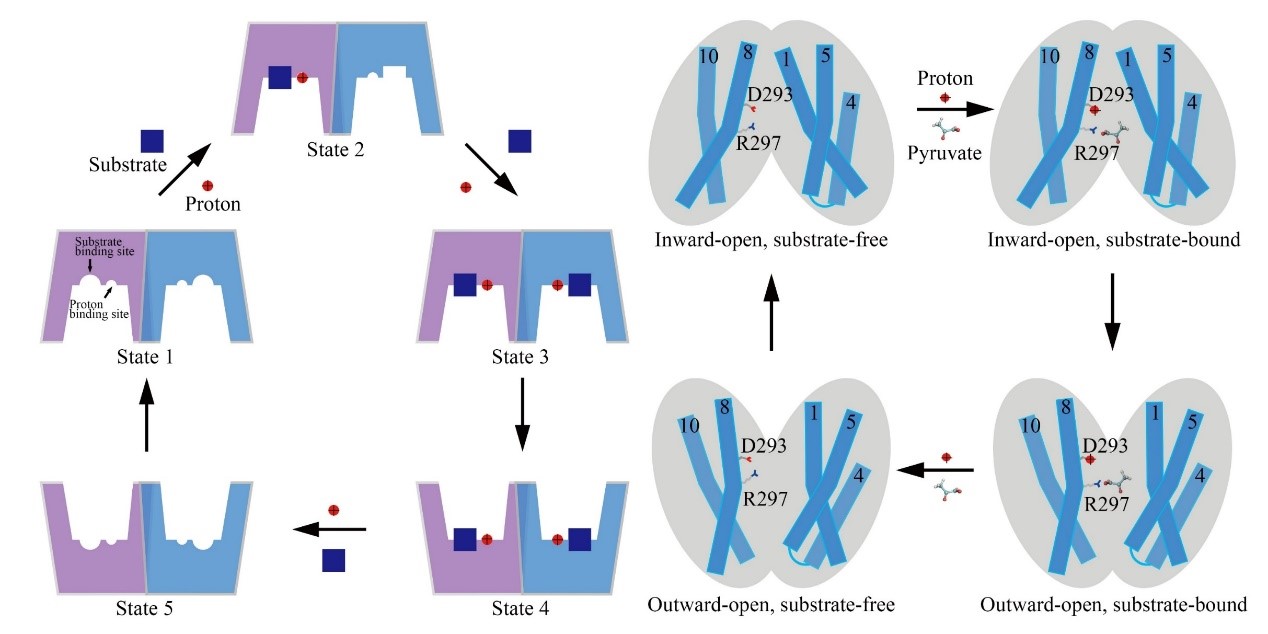
图1 MCT2的底物转运模型
继解析MCT2结构之后,叶升课题组又解析了MCT1-embigin异源二聚体的3.6 Å冷冻电镜结构。本研究中作者利用细胞成像技术分析了MCT1与embigin在细胞上的定位情况。发现单独的MCT1在胞质中累积,无法定位到质膜。而分子伴侣embigin可以辅助MCT1定位到质膜上。此外,使用体外亲和纯化技术,作者对二者的相互作用界面进行了突变分析,找到了MCT1与embigin相互作用的关键氨基酸残基。

图2 MCT1-embigin复合体的单颗粒冷冻电镜结构
通过与MCT2的结构进行比较,作者发现二者在结构上存在较大差异。首先就是embigin的单次跨膜螺旋TM与MCT2另一个亚基的TM8会产生空间位阻,从而破坏了MCT1二聚体的形成。其次,二者的TM1有一定的空间位置转变。而在MCT2协同转运中,TM1与另一亚基TM4-5之间形成的氢键网络是其协同效应存在的结构基础。最后,二者的底物结合中心有较大的不同,MCT1-embigin结构中MCT1的TM5是直的,但MCT2的TM5偏向底物结合中心约30°,从而引发底物结合中心的结构变化,进而影响底物亲和力。通过表面等离子体共振技术测定蛋白与底物的亲和力,发现MCTs蛋白在与其分子伴侣组成复合物之后,对底物的亲和力均具有不同程度的下降。推测由于MCT1的聚集状态发生变化,从而导致其转运底物的能力也随之变化。本文一定程度上支持了MCT2协同效应的存在,说明独特的二聚体形式是MCT存在协同转运的关键。
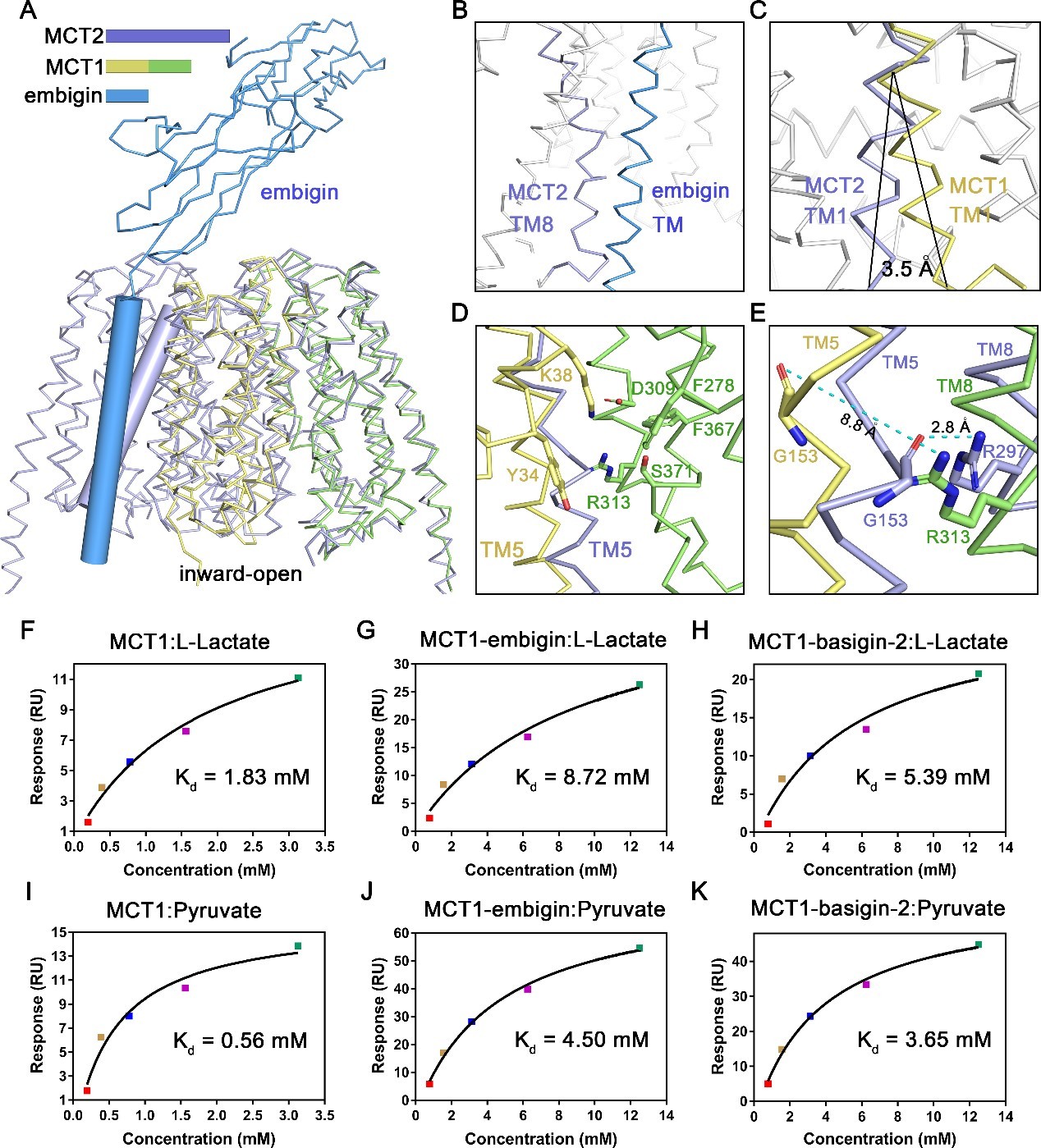
图3 MCT1-embigin复合体与MCT2结构比较及异源二聚体对底物亲和力的影响
综上,该研究工作深入揭示了embigin与MCT1互作,协助其定位于质膜,引发MCT1功能寡聚态改变及分子内部构象变化,从而调控底物转运活性的精确分子机制,是MCT蛋白存在协同效应的有力佐证。该工作也为后续靶向乳酸转运复合体的广谱抗癌药物的设计与开发奠定坚实的结构基础。
天津大学生命科学学院叶升教授课题组博士后徐冰红与西湖大学生命科学学院章明峰,浙江大学生命科学研究院张波,清华大学药学院池文娜,南方科技大学冷冻电镜中心马晓旻为本文的共同第一作者。天津大学生命科学学院叶升与天津大学生命科学学院严汉池,中国科学院深圳先进技术研究院/深圳理工大学(筹)张小康,清华大学药学院陈立功为本文的共同通讯作者。天津大学生命科学学院为第一单位。参与这项工作的还有西湖大学的裴端卿教授,该研究工作获得科技部、中国国家自然科学基金会、中央高校基本科研业务费等经费资助。
原文链接:https://doi.org/10.1016/j.celrep.2022.111343
(编辑 张华 万梦方)

