中东呼吸系统综合征冠状病毒(MERS-CoV)和人类免疫缺陷病毒(HIV)病毒作为严重影响人类健康,致病率高、变异快的烈性病毒,广谱性防治手段的开发一直是该领域研究的难点。2024年8月13-14日,天津大学生命科学学院王亚鑫、叶升团队与南京大学合作,在PLosPathogens和NatureCommunications上连续发文,团队在开发靶向MERS-CoV和HIV病毒的超高效广谱性纳米抗体研究中取得突破性进展,为高致病性病毒的防治提供了重要的研究基础。
进展一:
进入21世纪,人类已经遭受了三次冠状病毒大流行,其中MERS-CoV的致死率高达35%。该病毒可以引起人畜共患病,人类可以通过直接或间接接触其宿主单峰骆驼而感染,在沙特阿拉伯和韩国曾造成严重的疫情,并且每年在中东、西亚等诸多国家仍有散在病例的报道。随着病毒的不断变异和重组,极有可能会进化出人际传播能力增强的变异株。未来,MERS-CoV从动物宿主的外溢、突变和重组极有可能导致再次大流行。MERS-CoV感染的第一步是病毒表面的Spike糖蛋白与宿主细胞膜上的受体二肽基肽酶-4(humanDipeptidyl peptidase-4,hDPP4)的结合,这是启动MERS-CoV感染最关键的一步。抗体是阻断病毒感染这一关键过程的有效手段,近年来随着纳米抗体研究与应用的快速发展,逐渐成为抗病毒研究的热点。因此,亟需开发高效广谱、机制明确的MERS-CoV工程化纳米抗体,探寻新的抗原结合表位,为未来潜在的暴发风险提供及时的应对策略。
2024年8月14日,天津大学生命科学学院王亚鑫、叶升团队在病毒学权威TOP期刊PLosPathogens上在线发表题为“Structure defining of ultrapotent neutralizing nanobodies against MERS-CoV with novel epitopes on receptor binding domain”的研究论文。

该研究利用重组MERS-CoV的Spike蛋白免疫羊驼,成功分离出4株中和活性超高的纳米抗体(Nanobody,Nb),其中Nb14是目前所有报道的MERS-CoV抗体中中和活性最高的。为了探究纳米抗体的结合表位,团队利用X-射线衍射技术分别解析了Nb9、Nb14与病毒RBD的复合物结构,通过结构分析发现,Nb14的结合表位与以往报道的三类抗体表位均不同,为一个全新的抗体识别表位。与Nb14不同,Nb9结合于一个隐匿的表位,不与Nb14的表位重合,表明两种抗体可以进行联用,并且这两种抗体的结合位点均位于RBD与受体hDPP4的结合界面之外(图1)。

图1.Nb9、Nb14与RBD的复合物结构
为了进一步阐明两种纳米抗体的抗病毒分子机制,团队构建了关键位点突变的假病毒进行中和实验,结果表明Nb14并不是通过阻断蛋白-蛋白相互作用,而是通过影响受体hDPP4上聚糖与病毒RBD上W535和D539的结合这一关键入侵因素,干扰了病毒的感染。Nb14的结合导致RBD上W535位点的构象变化,阻断了受体hDPP4聚糖上N229与RBD的结合,同时纳米抗体CDR2上的R59与D539形成氢键,进一步干扰了hDPP4与RBD的结合。而Nb9的结合,诱导了RBDβ5-β6 loop构象的变化,该loop插入到RBD表面的凹槽中,影响了hDPP4上关键helix与RBD的结合(图2)。

图2.Nb9、Nb14阻断病毒感染的分子机制
鉴于MERS-CoV有多种变异株,团队利用假病毒检测了两种纳米抗体对不同毒株的中和作用,结果表明,Nb9与Nb14能高效中和MERS-CoV的主流变异株,提示了这两种纳米抗体具备广谱性特征。最后,由于Nb9与Nb14的特殊表位,团队检测了两者具有很好的协同性(图3)。综上所述,Nb9与Nb14表现出超高的中和活性、广谱性和协同性,具备发展为MERS-CoV抗体药物的巨大潜力,为未来应对疫情的再次暴发提供了研究基础。

图3.Nb9、Nb14的广谱性和协同性
天津大学生命科学学院博士研究生马森为本文的第一作者,天津大学生命科学学院叶升教授和王亚鑫副教授为本文的共同通讯作者,天津大学生命科学学院为本文第一单位,该研究得到科技部重点研发计划、国家自然科学基金的资助。
文章链接:
https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1012438
进展二:
艾滋病是HIV病毒引发的全身性疾病。HIV主要侵犯人体的免疫系统,未经治疗的感染者在疾病晚期易于并发各种严重感染和恶性肿瘤,最终导致死亡。HIV入侵宿主的主要受体是表达于T淋巴细胞、单核巨噬细胞以及树突状细胞表面的CD4分子。由于HIV的高变异性和多种流行株,目前尚无有效的疫苗和根治艾滋病的有效药物。尽管抗逆转录病毒疗法(ART)在抑制HIV复制方面取得了进展,但现有的抗病毒药物存在局限性,包括终身用药、频繁给药、副作用和病毒耐药性,因此亟需开发新的HIV治疗方法。
为了开发广谱性HIV纳米抗体,团队变换思路,将靶点转向了HIV的受体CD4,以期开发出高效的纳米抗体能广谱性中和HIV不同毒株的感染。本团队与南京大学吴喜林教授合作,开发出了高效广谱的CD4纳米抗体,研究论文于2024年8月13日在线发表在Nature子刊NatureCommunications上。

首先,团队利用重组CD4的D1-D2结构域免疫羊驼,分离出了具备高效中和活性的纳米抗体Nb457,利用多种HIV毒株假病毒检测了Nb457的中和活性。为了进一步阐明纳米抗体的抗病毒分子机制,团队解析了Nb457与CD4D1-D2的复合物晶体结构。结构分析表明Nb457通过诱导CD4构象的变化,将影响HIV病毒表面关键入侵因子gp120与受体CD4结合的位点F43拉远,进而导致了CD4与gp120的空间位阻,阻断HIV的感染(图4),并且Nb457与CD4的结合不干扰MHC-II的结合和T细胞的功能。
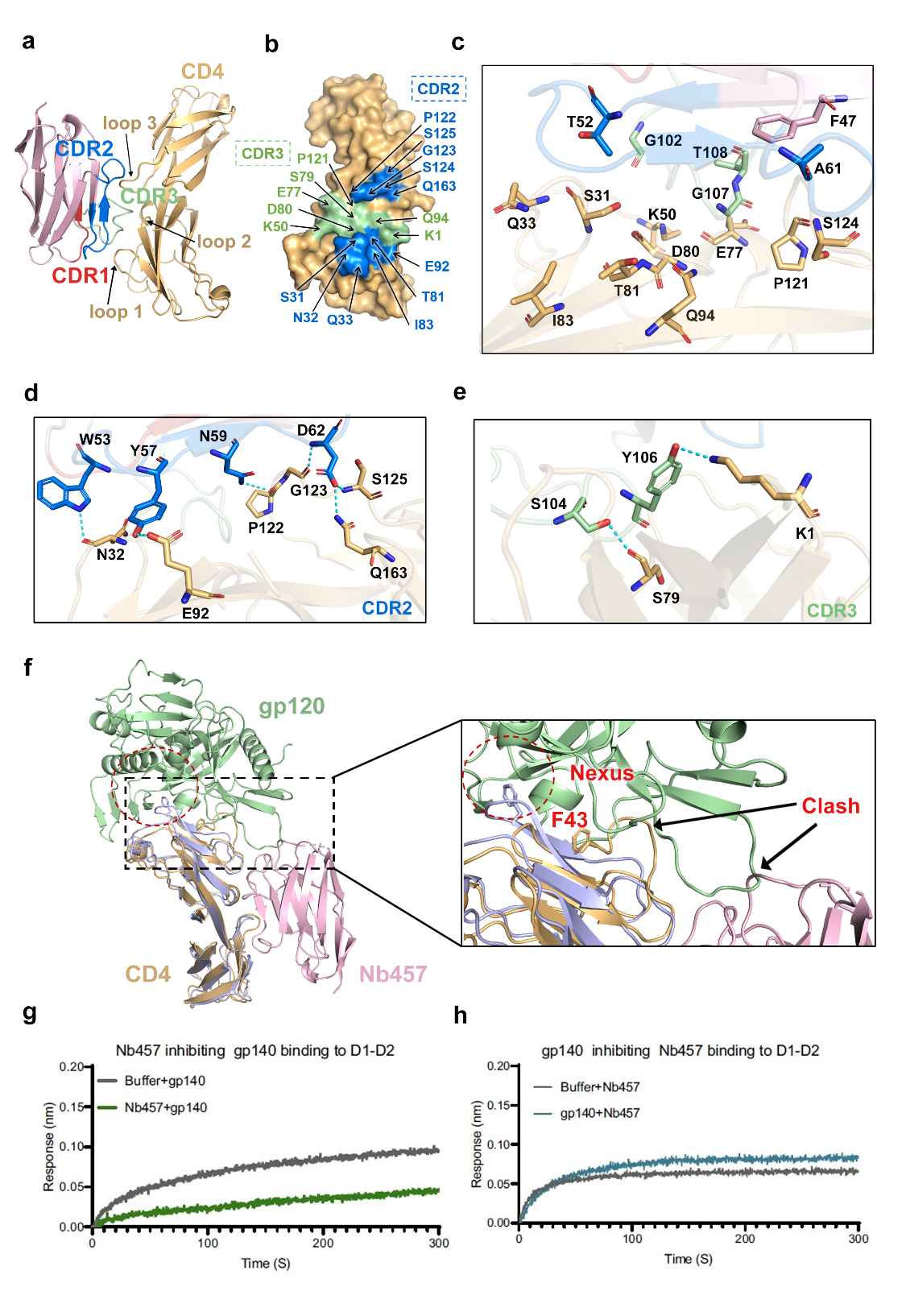
图4.Nb457与CD4的复合物结构与抗病毒分子机制
随后,团队构建了工程化的纳米抗体Nb457-NbHSA-Nb457,并利用活病毒和人源化小鼠检测了工程化纳米抗体的中和活性,结果表明,工程化纳米抗体均能高效广谱性中和主流的HIV毒株,并对人源化小鼠的保护性高达100%(图5)。

图5.工程化纳米抗体在活病毒和小鼠水平的中和活性评价
综上所述,本研究开发了一种具有应用前景的抗CD4的广谱性HIV抗体药物,为推动HIV这一全球健康挑战的临床治疗具有潜在的意义。南京大学医学院公共卫生研究中心研究生朱林静,黄碧莲和天津大学生命科学学院博士研究生王向尧为本文的共同第一作者,天津大学王亚鑫副教授,武汉病毒所刘雅兰副研究员和南京大学吴喜林教授为本文的主要共同通讯作者。
文章链接:
https://www.nature.com/articles/s41467-024-51414-6.pdf

