本站讯(药物科学与技术学院供稿)扩张型心肌病(DCM)是最常见的心肌病类型之一,也是造成心脏衰竭的主要原因之一。在受磷蛋白(PLN)中发现的若干突变与家族性扩张型心肌病和心脏衰竭有关,但潜在的分子机制仍不明确。在生理条件下,PLN通过与肌质网钙ATP酶(SERCA)相互作用,调节其钙摄取功能,而这一调节过程本身又受到蛋白激酶A (PKA)依赖性磷酸化的调节。为揭示PLN的遗传性突变引起心肌病的发病机制,天津大学尉迟之光研究组在eLife杂志发表了题为Structures of PKA-phospholamban complexes reveal a mechanism of familial dilated cardiomyopathy的研究文章。作者通过解析PKA与野生及突变型PLN的复合物蛋白晶体结构,并综合使用多种生物物理和生物化学方法,对致病突变进行了系统研究,揭示了一种导致扩张型心肌病的常见机制:PLN中的突变通过改变其构象减弱与PKA的相互作用,从而降低PLN的磷酸化水平。作者还发现另一种分布更为广泛的SERCA调节肽(ALN)具有与PLN相似的PKA依赖性调节机制。

25-35%的DCM病例具有家族起源,由编码与肌肉收缩和钙离子调控相关蛋白的基因遗传突变引起,其中包括PLN【1-4】。PLN是位于肌浆网上的单次跨膜蛋白,作为肌浆网钙泵SERCA的重要调控因子,通过可逆地抑制SERCA活性调节心肌的收缩。PLN对SERCA的抑制作用受钙离子浓度、氧化还原环境、PLN聚合形式及其磷酸化水平等多种因素的影响【5-6】。目前已经报道了多个位于PLN上的DCM相关家族遗传性突变,包括R9C、R9H、R9L、ΔR14、R14I、I18T等,但其致病机制仍不明确【7-10】。
研究团队解析了PKA与野生型及两种突变型PLN的复合物蛋白晶体结构。与曾经解析的PKA:PLN=2:1的野生型复合物结构相比,此次解析的PKA:PLN=1:1的野生型复合物结构更接近其真实溶液形式,揭示了在生理状态下PKA催化PLN底物的方式。团队解析的PKA+PLN A11E复合物晶体结构进一步区分了两种野生型结构模型,并证实了新解析野生型结构的合理性。R9C是表型最严重也是功能研究最为广泛的DCM相关突变,但由于结构信息缺失,其导致心肌病诱发的分子机制仍有争议。团队进一步解析了PKA与R9C突变型PLN的复合物晶体结构,显示R9C消除了精氨酸带正电荷的侧链与PKA结合口袋处带负电的α-螺旋偶极子之间的静电相互作用力,以及与PKA之间的氢键作用,从而使PLN改变构象并远离PKA,最终减弱二者间的相互作用(图1)。
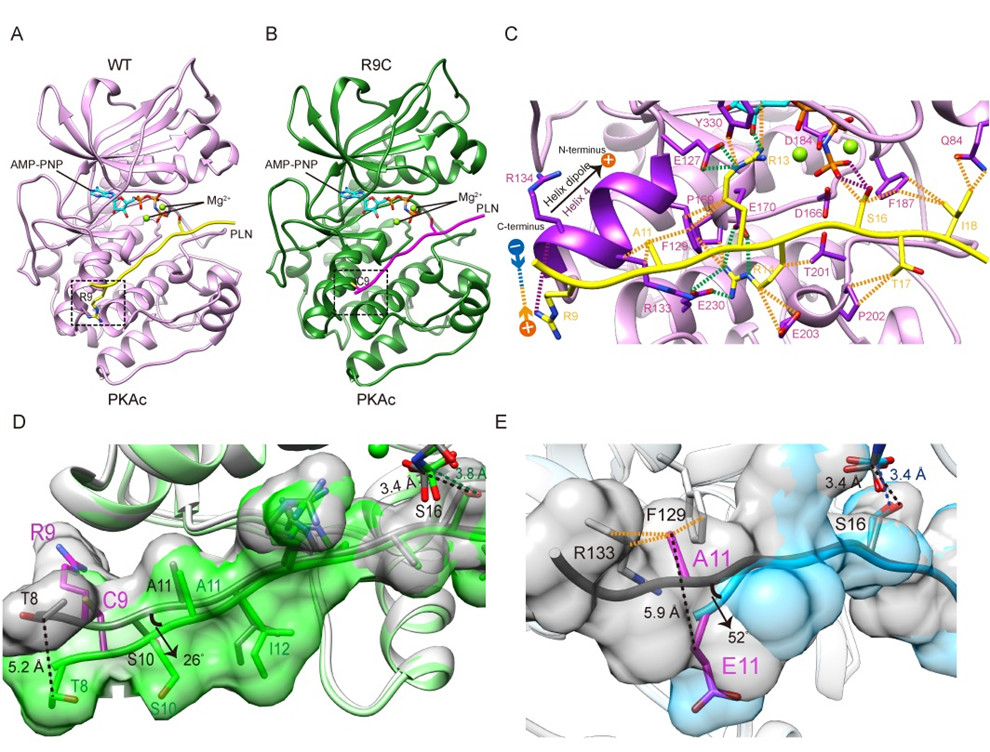
图1PKA与野生型及突变型PLN的复合物蛋白晶体结构
为了验证DCM突变是否影响PKA与PLN之间的结合,团队分别通过表面等离子共振技术、热稳定实验、ADP-Glo激酶实验以及NMR表征了二者之间的相互作用和酶动力学常数,发现多个突变确实通过改变其构象减弱了PLN与PKA之间的相互作用,以此降低了激酶的催化效率,从而达到减弱PLN磷酸化水平的表型。除了疾病突变,作者们发现由钙调蛋白依赖性蛋白激酶II(CaMKII)介导的PLN磷酸化也会减弱PLN与PKA的结合,并且降低PLN上PKA位点的磷酸化水平,证明不同激酶的信号通路之间存在串扰现象(图2)。

图2(A)表面等离子共振;(B)热稳定实验;(C)ADP-Glo激酶实验
为研究SERCA调节肽受PKA磷酸化调节机制的普适性,作者们对近期新鉴定发现的SERCA调节肽ALN进行了类似相关研究。ALN是一种表达于内质网膜上的单次跨膜蛋白,在包括心肌在内的多个组织器官都有广泛表达。ALN上负责与SERCA相互作用的跨膜结构域在序列上与PLN相对保守,而位于胞质一侧的潜在磷酸化调节位点序列并不保守。实验结果表明ALN可以被PKA磷酸化,然而与PLN相比,ALN与PKA结合的亲和力以及其磷酸化水平均有所下降。
本研究为深入了解DCM的病理机制提供了重要理论依据,同时也为理解PLN在肌肉细胞钙离子信号通路中的生理功能以及PKA的一般催化机制提供了重要线索。
天津大学药物科学与技术学院尉迟之光教授和张雁教授为该论文的共同通讯作者,天津大学药物科学与技术学院博士生秦鹃为本文的唯一第一作者。中科院武汉物理与数学研究所张景凤副研究员、天津大学林志教授、Kenneth J Woycechowsky教授和博士生林联云、加拿大英属哥伦比亚大学Filip Van Petegem教授和Omid Haji-Ghassemi博士对本文做出了重要贡献。本课题受到国家自然科学基金优秀青年基金、天津市自然科学基金的联合资助。项目实施还得到了上海光源X-射线衍射设施的支持和帮助。天津大学尉迟之光课题组致力于关键药物靶标的结构功能研究及药物筛选开发,课题组网站:www.yuchilab.com。
【参考文献】
1.Alves, M.L., R.D. Gaffin, and B.M. Wolska, Rescue of familial cardiomyopathies by modifications at the level of sarcomere and Ca2+ fluxes. J Mol Cell Cardiol, 2010. 48(5): p. 834-42.
2.MacLennan, D.H., Ca2+ signalling and muscle disease. Eur J Biochem, 2000. 267(17): p. 5291-7.
3.MacLennan, D.H. and E.G. Kranias, Phospholamban: a crucial regulator of cardiac contractility. Nat Rev Mol Cell Biol, 2003. 4(7): p. 566-77.
4.Kranias, E.G. and D.M. Bers, Calcium and cardiomyopathies. Subcell Biochem, 2007. 45: p. 523-37.
5.Ha, K.N., et al., Lethal Arg9Cys phospholamban mutation hinders Ca2+-ATPase regulation and phosphorylation by protein kinase A. Proc Natl Acad Sci U S A, 2011. 108(7): p. 2735-40.
6.Yu, X. and G.A. Lorigan, Secondary structure, backbone dynamics, and structural topology of phospholamban and its phosphorylated and Arg9Cys-mutated forms in phospholipid bilayers utilizing 13C and 15N solid-state NMR spectroscopy. J Phys Chem B, 2014. 118(8): p. 2124-33.
7.Schmitt, J.P., et al., Dilated cardiomyopathy and heart failure caused by a mutation in phospholamban. Science, 2003. 299(5611): p. 1410-3.
8.Medeiros, A., et al., Mutations in the human phospholamban gene in patients with heart failure. Am Heart J, 2011. 162(6): p. 1088-1095 e1.
9.Burns, C., et al., Multiple Gene Variants in Hypertrophic Cardiomyopathy in the Era of Next-Generation Sequencing. Circ Cardiovasc Genet, 2017. 10(4).
10.Schmitt, J.P., et al., Alterations of phospholamban function can exhibit cardiotoxic effects independent of excessive sarcoplasmic reticulum Ca2+-ATPase inhibition. Circulation, 2009. 119(3): p. 436-44.
全文链接:https://elifesciences.org/articles/75346
(编辑 张华 张佳丽)

