本站讯(生命科学学院供稿)阿尔兹海默症(AD)是一种常见的神经退行性疾病,目前全世界约有5000万AD患者。在AD发生发展过程中,存在着明显的性别差异现象,女性对AD具有更高的易感性,女性AD患者的发病率和死亡率是男性的2至3倍,但却尚无针对女性的特异性AD治疗方法。
研究表明,与同年龄段的男性相比,进入围绝经期后女性体内雌激素水平的显著降低可能是女性患AD风险更大的诱因。雌激素在女性体内扮演着中枢神经保护的重要角色,其通过与脑中的雌激素受体β(ERβ)结合,发挥促进神经元生长和分化、维持脑内氧化还原稳态等功能。长期大量缺失雌激素会促进神经退行性病变,加速认知能力下降,导致绝经后女性患AD风险急剧增加。
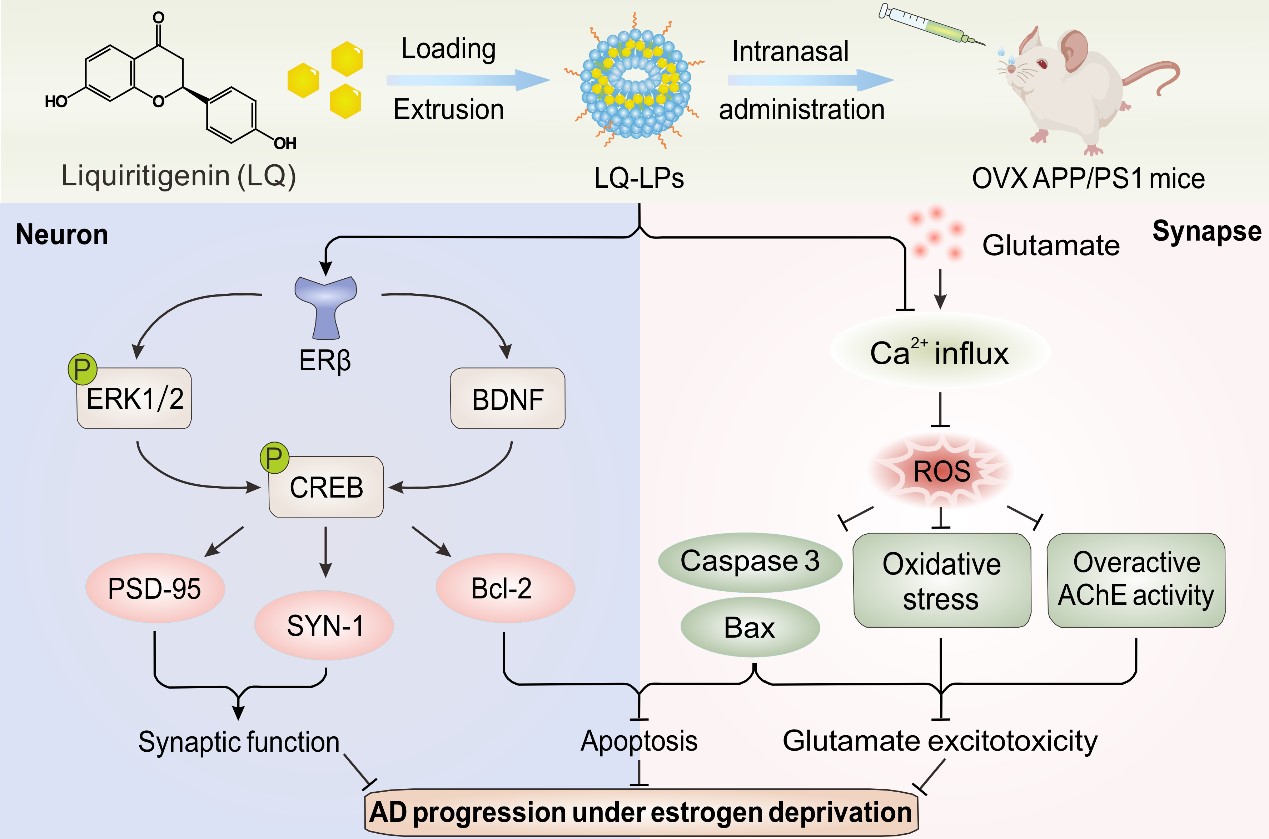
近日,天津大学生命科学学院常津教授和天津医科大学总医院窦妍副研究员合作,在《Nano Today》(IF = 17.4,一区TOP)上发表了题为”Female-sensitive multifunctional phytoestrogen nanotherapeutics for tailored management of postmenopausal Alzheimer's disease” 的研究论文,首次基于植物雌激素甘草素(LQ)研发了一种纳米药物(LQ-LPs),实现对绝经后女性AD的特异性治疗。得益于脂质体负载所提高的生物利用度和缓释效果,该纳米药物可激活ERβ介导的神经保护信号通路,显著改善雌激素剥夺诱导的氧化应激、胆碱能异常、神经元损伤和突触功能障碍,经鼻给药后,有效缓解了去卵巢雌性APP/PS1小鼠的认知功能障碍。

在体内外雌激素剥夺的AD模型中,该纳米药物一方面能够增强ERβ介导的突触保护和抗凋亡信号级联,另一方面可缓解过量谷氨酸引起的Ca2+内流和乙酰胆碱酯酶(AChE)过度激活,抑制神经元氧化损伤和胆碱能功能障碍。凭借依赖于鼻腔给药的脑内有效递送,LQ-LPs治疗可显著提高去卵巢APP/PS1小鼠海马中ERβ的表达,激活突触保护和抗凋亡通路,抑制氧化应激、钙超载、胆碱能功能障碍及神经元损伤,最终有效缓解了去卵巢AD小鼠中严重恶化的认知功能障碍。这项研究首次提出了植物雌激素在雌激素剥夺下对AD的个体化纳米治疗方案,为女性特异性AD治疗提供了新策略和新思路。
天津大学生命科学学院常津教授和天津医科大学总医院窦妍副研究员为本文的共同通讯作者。天津大学生命科学学院硕士生陈紫瑶和博士生赵冬菊为本文的共同第一作者。天津医科大学程萌,天津大学杨帆、刘逸宁也为该研究做出了贡献。天津大学生命科学学院为本论文第一完成单位,该研究获得国家自然科学基金、天津市自然科学基金、天津市医学重点学科(专科)建设项目等经费资助。
原文链接:
https://doi.org/10.1016/j.nantod.2023.102119
(编辑 刘晓艳 段智馨)

