本站讯(生命科学学院供稿)具有耐药性的细菌和免疫逃逸能力的病毒是全球公共卫生安全的重大威胁。在生物体的免疫系统中存在一道天然抵御病原体的防线antimicrobial peptides(AMP,抗微生物多肽或抗菌肽)。AMP主要通过破坏细菌细胞膜的完整性快速杀死细菌,且由于病毒表面包膜与细菌膜有着相似组成成分,AMP同样存在有抗病毒作用。随着人工智能技术的兴起,深度学习模型为加速抗感染药物设计进程提供了有效的解决方案。尽管近年来研究者不断开发模型挖掘到新的AMP,但相较于庞大的多肽序列空间,已知多肽序列可谓沧海一粟,且当前缺乏同时具有抗菌、抗病毒广谱功能的AMP的方法与流程。
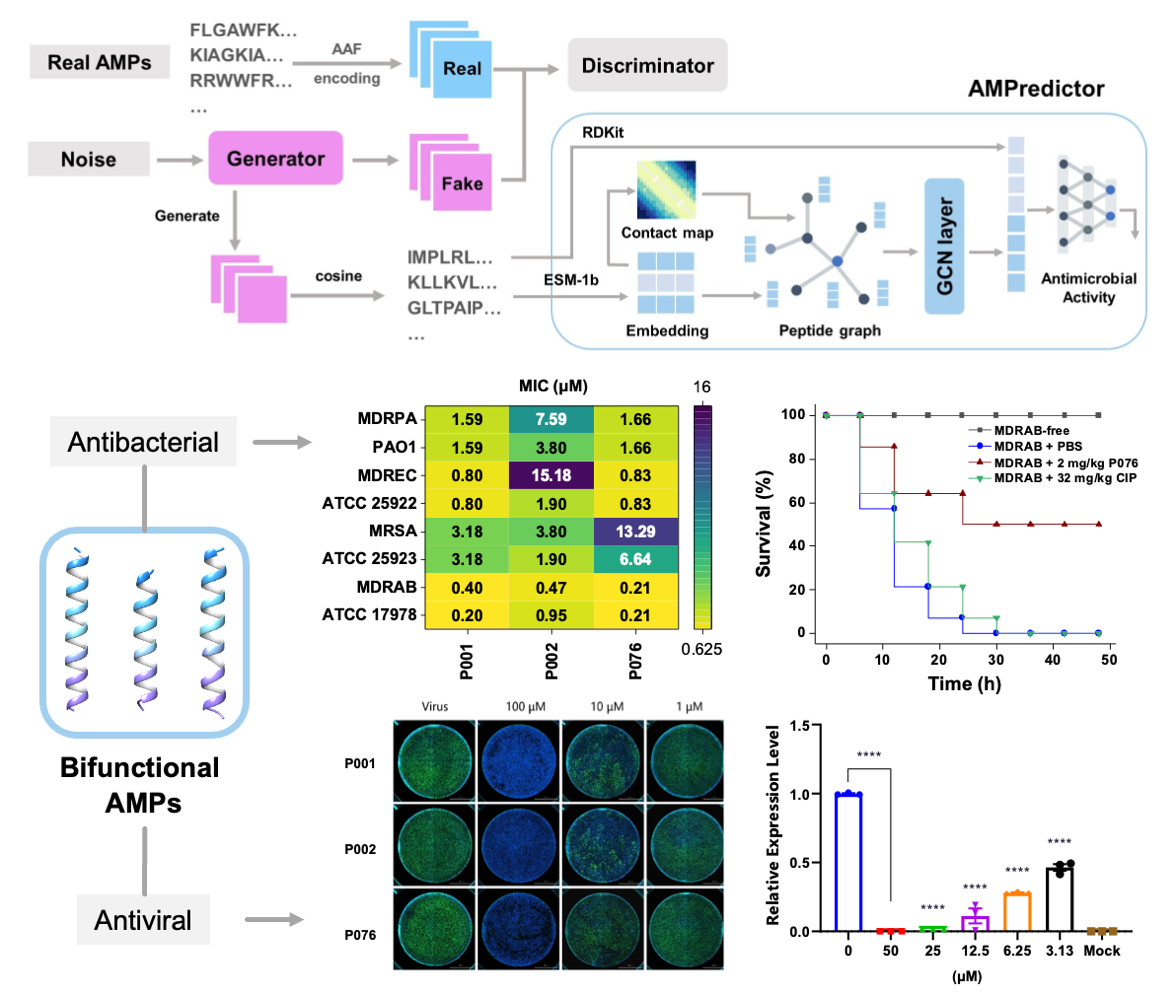
近日,天津大学生命科学学院祝诚、叶升研究团队在eLife期刊发表了题为“Exploring the repository ofde novodesigned bifunctional antimicrobial peptides through deep learning”的研究论文,基于生成对抗网络(GAN)模型结合多步筛选设计具有抗细菌、抗病毒双重功能的多肽分子,并通过实验证实了所设计的双功能肽均具有广谱抑制细菌和包膜病毒的功能。

本研究的主要创新点有,自主开发的基于深度图神经网络的打分模型AMPredictor对最小抑菌浓度(MIC)值的预测精度高。类比于药物虚拟筛选中的打分函数,AMPredictor可以快捷的判断任意多肽序列的抗菌潜能。新设计的P076能有效抑制被世卫组织(WHO)列为“极为重要”的抗菌药物开发对象——多重耐药鲍曼不动杆菌(MDRAB),MIC达到0.21μM,这一数值不但远优于多数现有抗菌肽,也优于被称为临床“最后一道防线”的多黏菌素分子。随后该研究在大规模的腹腔感染小鼠模型上验证了其安全性和有效性。在抗病毒方面,研究通过qRT-PCR、免疫荧光实验、透射电镜等手段证实了设计多肽对汉坦病毒、基孔肯雅病毒、1型单纯疱疹病毒和2型登革病毒具有抑制作用,且可抑制新冠疫情相关的SARS-CoV-2病毒的野生株和BA.2亚型。
综上,该研究开发了一种高效设计双功能AMP序列的计算流程,不仅为治疗耐药细菌感染以及病毒感染导致的疾病提供了新的候选药物,也为拓展双功能肽空间提供了全新方案。
天津大学生命科学学院本科毕业生董睿涵为论文第一作者。天津大学英才副教授祝诚、讲席教授叶升为共同通讯作者。天津大学生命科学学院为本文第一单位。中国人民解放军空军军医大学、陆军军医大学、海军军医大学均为本研究重要合作单位。其中空军军医大学吴兴安教授和陆军军医大学王成副教授为本文的共同通讯作者。空军军医大学刘蓉蓉副教授、刘梓谕,海军军医大学刘延刚为本文的共同第一作者。陆军军医大学王军平教授、海军军医大学赵平教授以及中南大学郭菲教授参与指导该研究。该研究得到科技部重点研发计划、国家自然科学基金等项目资助。
(编辑 张华 来瑞兮)

