本站讯 (生命科学学院供稿)WDR5/MLL1-H3K4me3表观遗传通路在肿瘤细胞和免疫细胞中常常被激活,驱动肿瘤微环境中的多种细胞反应。然而目前对其的研究仅限于血液肿瘤领域,在实体瘤中的功能尚不清楚。

近日,天津大学生命科学学院英才副教授吕春婉团队在International Journal of Molecular Sciences 期刊上发表题为“The Wdr5-H3K4me3 Epigenetic Axis Regulates Pancreatic Tumor Immunogenicity and Immune Suppression”的研究论文,本研究发现WDR5在人胰腺肿瘤组织中的表达水平高于癌旁正常组织,并且在体外和体内实验中证实WDR5的缺失或抑制可导致胰腺癌细胞中MHC-I分子表达的显著下调。
本研究首先发现WDR5在人胰腺肿瘤组织中的表达水平高于癌旁正常组织,同时在人肿瘤细胞中WDR5的表达水平与HLA分子的表达水平呈正相关,并且在HLA-A、B、C三种亚型的启动子区域都存在H3K4me3的富集(图1)。
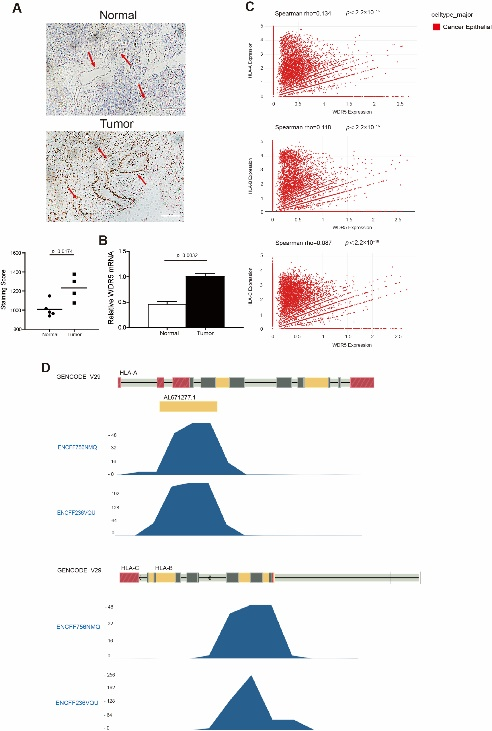
图1:WDR5在人肿瘤组织中具有较高的表达水平,并且在人肿瘤中与HLA的表达水平呈正相关
基于此结论,研究团队对其机制展开研究。首先使用Crispr技术在小鼠胰腺癌细胞PANC02中敲除WDR5基因,通过Western Blotting,qPCR,流式细胞术等方法分别从RNA和蛋白水平证实:敲除WDR5基因后,H2Kb和H2Db两类MHC-I分子表达下调,同时在小鼠体内胰腺肿瘤模型得出相同的结论(图2)。进一步通过ChIP实验证实:敲除WDR5基因后,H3K4me3在MHC-I启动子上的富集程度显著下降(图3)。

图2:Wdr5在体内和体外均能提高小鼠肿瘤细胞中MHC-I分子的表达

图3:敲除WDR5可降低H3K4me3在MHC-I分子启动子上的富集程度
为进一步探究WDR5的敲除对肿瘤大小无明显影响的原因,研究团队分别对总肿瘤组织和CD45-部分进行qPCR检测,结果表明:WDR5的敲除可有效降低胰腺肿瘤微环境中免疫检查点(PD-1、PD-L1、Spp1)和免疫抑制性细胞因子(IL6)的表达水平(图4),从而显著改善CD8+/CD4+T细胞在肿瘤微环境中的浸润程度,因此中和了WDR5敲除所导致的MHC-I表达下调的效应。该结果提示:在基于WDR5的表观遗传肿瘤免疫治疗中,应考虑WDR5-MHC-I通路的选择性激活和WDR5-免疫检查点/细胞因子通路的选择性抑制。

图4:Wdr5缺失可逆转免疫抑制性的肿瘤微环境
该论文的第一作者为天津大学生命科学学院硕士生邓铠玓,独立通讯作者为天津大学生命科学学院英才副教授吕春婉,天津大学生命科学学院为本论文的第一通讯单位。本研究由天津大学和北京协和医学院药物研究所合作完成,获得国家自然科学基金的支持。
原文链接:https://www.mdpi.com/1422-0067/25/16/8773

