本站讯(生命科学学院供稿)恶性肿瘤,包括肝癌、肺癌、结直肠癌和乳腺癌,是全球范围内导致死亡的主要原因之一。在寻求新疗法的过程中,由SLC16A1编码的单羧酸转运蛋白1(MCT1)因其在癌细胞代谢中的作用而被广泛关注。在缺氧条件下,癌细胞通过糖酵解快速增殖,产生乳酸,随后被氧化癌细胞摄取,这一过程被称为“代谢共生”。与此同时,MCT1介导乳酸在肿瘤微环境中的积累,创造了一个免疫抑制环境,以帮助癌细胞逃避免疫攻击。因此,开发MCT1的抑制剂成为抗肿瘤疗法的重要方向,明确MCT1转运机制成为靶向药物开发的前提。
叶升/徐冰红课题组一直致力于研究单羧酸转运蛋白的结构功能机制。叶升课题组在2020年通过活细胞成像技术,发现人源单羧酸转运体2(MCT2)在转运丙酮酸时存在协同性(希尔系数n = 1.6),通过结构解析,他们发现独特的二聚体形式是MCT2存在底物协同转运的结构基础[1]。2022年,叶升/徐冰红团队又解析了MCT1-embigin的单颗粒冷冻电镜结构,并通过细胞成像技术,体外亲和纯化技术以及表面等离子体共振等研究手段,揭示了伴侣蛋白embigin调控人源单羧酸转运体1(MCT1)定位在细胞膜上和改变MCT1协同转运的分子机制[2]。然而,乳酸的跨膜转运是一个伴随蛋白构象变化和质子驱动的动态过程,从结构角度阐明这一过程极具挑战性。此外,能否根据已有结构筛选鉴定出新的能通过靶向MCT来抑制肿瘤发生发展的先导药物分子也是团队关注的另一重点。
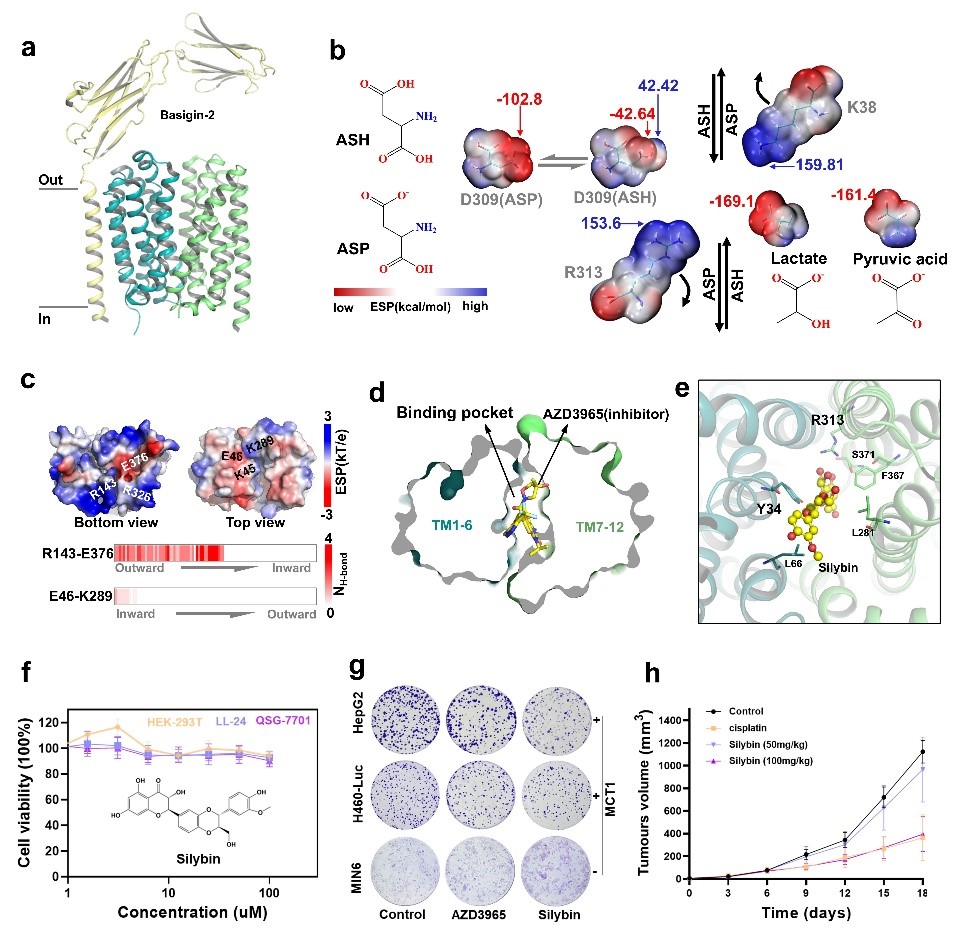
2025年3月17日,天津大学医学部生命科学学院叶升/徐冰红/王亚鑫团队在《Acta Pharmacologica Sinica》在线发表了Transport Mechanism and Drug Discovery of Human Monocarboxylate Transporter 1的研究论文。该团队使用多尺度模拟和奇异值分解等方法来阐明MCTs的变构机制,提出了一个合理的质子和乳酸共转运模型,鉴定了一种选择性MCT1抑制剂。这些发现推进了对MCT1分子层面的理解,并为针对此转运蛋白的合理药物设计奠定了基础。

研究团队通过对MCTs结构分析和增强采样模拟确定了维持MCT1蛋白外向和内向构型的主要相互作用,定点突变和底物转运实验表明,突变E46和E376会干扰转运蛋白稳态形成从而降低MCT1的转运功能。在底物转运实验中,团队发现MCT1的D309质子化步骤对于启动乳酸运输至关重要,当D309被质子化,乳酸会在R313的帮助下进入核心口袋。只有当D309去质子化时,乳酸才能被释放,而K38在这个过程中起到辅助作用。D309的去质子化状态产生关键的负电荷,促进乳酸释放,而质子化状态缺乏乳酸解离所需的排斥力。该机制的提出显著提升了对MCT1工作机制的理解。最后,团队在乳酸结合区域进行药物筛选,发现了一种选择性的MCT1抑制剂,Silybin,该分子能够靶向MCT1从而抑制肝癌肿瘤的生长。
天津大学医学部生命科学学院叶升教授、徐冰红副研究员、王亚鑫副教授、李振鲁副教授为本文的共同通讯作者。天津大学医学部生命科学学院博士后史赛(现河北医科大学副教授、硕士生导师),研究生李嘉辰、周晓雨为本文共同第一作者,该工作得到了国家自然科学基金,科技部重点研发计划,河北省燕赵黄金台聚才计划骨干人才项目支持。
原文链接
https://doi.org/10.1038/s41401-025-01517-7
参考文献
[1]Zhang B, Jin Q, Xu L, Li N, Meng Y, Chang S, Zheng X, Wang J, Chen Y, Neculai D, Gao N, Zhang X, Yang F, Guo J, Ye S. Cooperative transport mechanism of human monocarboxylate transporter 2.Nat Commun. 2020 May 15;11(1):2429. doi: 10.1038/s41467-020-16334-1.
[2] Xu B#, Zhang M#, Zhang B#, Chi W#, Ma X#, Zhang W, Dong M, Sheng L, Zhang Y, Jiao W, Shan Y, Chang W, Wang P, Wen S, Pei D, Chen L*, Zhang X*, Yan H*, Ye S*. Embigin facilitates monocarboxylate transporter 1 localization to the plasma membrane and transition to a decoupling state.Cell Reports.2022 Sep 13;40(11):111343. doi: 10.1016/j.celrep.2022.111343.
(编辑 焦德芳 牛和旭)

