ATP,被誉为细胞的“通用能量货币”,不仅在细胞内参与能量代谢,也被发现存在于细胞外环境中。在真核生物(例如哺乳动物)中,胞外ATP(eATP)作为重要的信号分子,参与调控神经传递、免疫应答等多种生理与病理过程。然而,在原核生物(例如细菌)中,eATP如何被感知及其在原核细胞信号传导中的作用机制一直是未解之谜。

近日,天津大学医学部生命科学学院林志教授团队在PNAS上发表了题为eATP sensing by the purinergic receptor PA2072 for allosteric modulation in intracellular c-di-GMP signaling的研究论文。这项研究揭示了铜绿假单胞菌通过跨膜受体PA2072特异识别并响应eATP信号,进而调控细胞内第二信使c-di-GMP水平的分子机制。
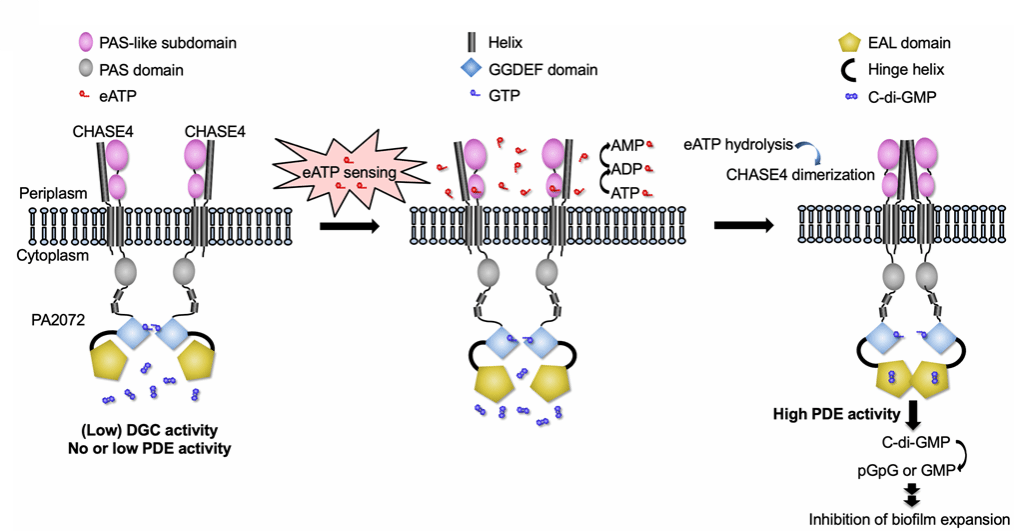
本研究聚焦于临床常见的耐药病原菌,铜绿假单胞菌(Pseudomonas aeruginosa)。研究团队发现,该菌体内的嘌呤受体PA2072是感知eATP的关键“哨兵”。其位于周质空间的CHASE4结构域能响应eATP,变构调控PA2072胞内结构域的构象和下游信号。通过核磁共振(NMR)等技术进一步发现了该结构域能特异性结合并水解ATP,展现出独特的ATP酶活性:该酶的催化活性对金属离子(如 Mg²⁺等)不严格依赖。结构分析揭示了一个精巧的“分子开关”:具有催化活性的CHASE4单体通过水解eATP所释放的自由能,引发自身构象的微妙变化,进而促成同源二聚化,抑制了自身ATP酶活性。这种变化如同一个信号转换开关,在“关闭”周质区ATP酶活性的同时,“开启”细胞质端的磷酸二酯酶(PDE)功能,促使细胞内第二信使 c-di-GMP水平下降。c-di-GMP是调控细菌生物膜形成、运动性及致病性等关键行为的核心分子。细胞在这一系列紧密协调的反应中,呈现出一种如同精心设计般的智能应答。
综上,此项工作揭示了PA2072作为跨膜变构调节受体,将胞外信号转化为胞内功能输出的主要过程。这一机制的阐明,不仅加深了我们对细菌与宿主相互作用的分子层面理解,也为抗感染治疗提供了新的策略。此外,与真核生物中较为直接的eATP感知方式相比,来自原核生物的PA2072通过更加模块化的结构,实现eATP识别和水解过程与胞内c-di-GMP信号调控的有序耦合,为合成生物技术中构建可编程信号转导模块提供了新的潜在模型。
天津大学医学部生命科学学院已毕业博士生张燕、宁夏医科大学基础医学院博士生高晓菁和天津大学医学部生命科学副教授肖云杰为本论文共同第一作者。通讯作者为天津大学医学部生命科学学院林志教授、宁夏医科大学基础医学院黄卫东教授和天津大学医学部生命科学学院王泽方教授。天津大学袁文肃副教授、陈成副教授、晋兴华高级工程师,以及南开大学苏循成教授、中山大学附属第七医院尹国维副研究员等多个团队为此工作提供了大力支持。
原文链接:https://doi.org/10.1073/pnas.2423664122
